Как примеси изменяют температуру замерзания чистой воды
Статья обновлена: 28.02.2026
Дистиллированная вода в идеальных условиях замерзает строго при 0°C – этот эталонный показатель известен из школьных учебников. Однако в реальности абсолютно чистый образец воды достижим лишь в лабораториях с особыми протоколами очистки, тогда как даже минимальные посторонние включения кардинально меняют физические свойства жидкости.
Данная статья исследует, как разные виды примесей – от растворённых солей и металлов до органических соединений – смещают точку фазового перехода воды в лёд. Понимание этих механизмов критично для климатологии, машиностроения и контроля качества фармацевтических субстанций.
Температура замерзания дистиллированной воды: влияние примесей
Чистая дистиллированная вода кристаллизуется при строго определённой температуре в стандартных условиях. Это значение является фундаментальной физической константой и точкой отсчёта для температурных шкал. Любые отклонения от химической чистоты H2O неизбежно сдвигают температурный порог фазового перехода.
Точное значение температуры замерзания чистой воды при атмосферном давлении 1 атм (101,325 кПа) составляет 0°C или 273,15 K. Данная величина определена Международным бюро мер и весов как фиксированная точка шкалы ITS-90. Незначительные колебания могут возникать только при изменении давления: повышение на 1 атм снижает температуру замерзания примерно на 0,0072°C.
Механизм влияния примесей

Добавление любых веществ в воду всегда понижает температуру её замерзания. Этот эффект объясняется:
- Коллигативными свойствами: растворённые частицы нарушают структуру кристаллической решётки льда.
- Снижением химического потенциала жидкой фазы, требующего большего переохлаждения для начала кристаллизации.
Степень понижения (ΔTf) зависит от концентрации частиц и описывается уравнением:
- Для неэлектролитов: ΔTf = Kf × m, где Kf = 1,86 °C·кг/моль (криоскопическая постоянная воды), m – моляльная концентрация.
- Для электролитов: ΔTf = i × Kf × m, где i – изотонический коэффициент (учитывает диссоциацию).
Примеры практического воздействия:
| Тип примеси | Воздействие на t° замерзания |
|---|---|
| Поваренная соль (10%) | ≈ -6 °C |
| Этиленгликоль (25%) | ≈ -11 °C |
| Морская вода (средняя солёность) | ≈ -1,9 °C |
Таким образом, чистота воды является критическим фактором для достижения эталонного значения температуры фазового перехода. Реальное поведение природных вод и технических растворов всегда требует учёта концентрации и типа растворённых веществ.
Лабораторные методы получения дистиллированной воды
Стандартным методом лабораторного получения дистиллированной воды является паровая дистилляция. В дистилляционном аппарате воду доводят до кипения, а образующийся пар конденсируют в охлаждаемой трубке, отделяя соли, неорганические примеси и микроорганизмы. Для повышения чистоты проводят двукратную или трехкратную перегонку, иногда с добавлением перманганата калия для окисления органики.
Альтернативные подходы включают деионизацию через ионообменные смолы, где катионы и анионы замещаются на H⁺ и OH⁻, но полученная вода сохраняет неионные загрязнители. Технология обратного осмоса использует полупроницаемые мембраны, задерживающие до 99% растворенных веществ под давлением, хотя требует предварительной фильтрации.
Критические факторы выбора метода
Для сравнения характеристик основных методов применяют следующие параметры:
| Метод | Очистка от солей | Удаление летучих примесей | Производительность |
|---|---|---|---|
| Простая дистилляция | ≥99% | Низкая | 0.5-2 л/ч |
| Многократная дистилляция | ≥99.9% | Средняя | 0.1-0.7 л/ч |
| Ионообменные смолы | ≥99% | Неэффективно | 3-20 л/ч |
| Обратный осмос | 98-99% | Частично* | 10-100 л/ч |
* Эффективность зависит от типа мембраны и давления
Для сверхчистой воды (анализ следов металлов) применяют комбинации: например, предварительный обратный осмос с последующей дистилляцией в кварцевой аппаратуре. Кальциевые отложения предотвращают добавлением трилона Б, а биозагрязнения – УФ-стерилизацией паропроводов.
Принцип работы криоскопа: измерение депрессии замерзания
Криоскоп – это прибор, определяющий температуру замерзания чистых жидкостей и растворов. Основная задача: точно зафиксировать момент кристаллизации пробы при постоянном охлаждении. Для воды с примесями этот момент наступает при более низких температурах, чем у дистиллированной воды.
Работа основана на коллигативных свойствах растворов: понижение точки замерзания (депрессия ΔT) прямо пропорционально моляльной концентрации растворённых частиц. Принцип описывается уравнением ΔT = Kf · m · i, где Kf – криоскопическая постоянная (для воды 1,86 °C·кг/моль), m – моляльность раствора, i – изотонический коэффициент.
Ключевые этапы измерения:
- Образец помещают в охлаждаемую камеру с непрерывным перемешиванием для предотвращения переохлаждения.
- Термодатчик регистрирует температурную кривую. При начале кристаллизации выделяется теплота фазового перехода, вызывая плато на графике температуры.
- Фиксация температуры плато: сравнение с эталоном чистого растворителя даёт значение депрессии ΔT.
Факторы точности:
- Скорость охлаждения: слишком высокая → переохлаждение искажает плато.
- Перемешивание: скорость и равномерность критичны для формирования стабильного фронта льда.
- Калибровка: прибор тестируют на чистой воде для проверки эталонной точки 0°C.
Расчёт примесей:
По экспериментальной ΔT вычисляют количество частиц в растворе. Замеряя депрессию для неизвестного образца, находят его молярную массу или концентрацию примесей. Например, добавление 1 моля NaCl на кг воды даёт ΔT ≈ 3,72°C (i ≈ 2).
Влияние растворенных веществ на температуру кристаллизации воды
Растворенные вещества существенно понижают температуру замерзания раствора по сравнению с чистым растворителем. Основной причиной этого понижения является принцип, согласно которому температура фазового перехода жидкость-твердое вещество (кристаллизация) зависит от химического потенциала вещества в обеих фазах. Добавление растворенных частиц нарушает чистое состояние растворителя и влияет на способность его молекул упорядочиваться в кристаллическую решетку льда.
Главный термодинамический эффект заключается в изменении химического потенциала жидкой фазы растворителя при растворении нелетучего вещества. В точке замерзания чистого растворителя химические потенциалы жидкой и твердой фаз равны. Растворенные частицы снижают химический потенциал жидкой фазы, не влияя на потенциал твердой фазы (кристалла чистого растворителя). Это нарушает равновесие: химический потенциал жидкости теперь ниже потенциала твердой фазы. Для восстановления равновесия при более низкой температуре требуются дополнительные факторы.
Механизм понижения температуры замерзания
Ключевым фактором нарушения кристаллизации является физическое присутствие растворенных частиц (ионов или молекул) в жидкости. Эти частицы:
- Мешают упорядочению: Создают пространственные и энергетические барьеры, препятствующие движению молекул воды в необходимые позиции для формирования стабильной кристаллической решетки льда.
- Снижают эффективную концентрацию молекул воды: Часть поверхности зарождающегося кристалла льда блокируется примесями, не способными встроиться в решетку. Это затрудняет присоединение новых
свободных
молекул H2O к зародышу кристалла. - Требуют более низкой температуры: Чтобы преодолеть помехи, создаваемые частицами, и достичь достаточной движущей силы (разности химических потенциалов) для кристаллизации *чистого* растворителя, необходимо охладить раствор ниже нормальной точки замерзания воды.
Величина понижения точки замерзания (ΔTзам.) не зависит от природы растворенного вещества (коллигативное свойство), а определяется только его моляльной концентрацией (m) в растворе: ΔTзам. = Kк · m, где Kк - криоскопическая постоянная растворителя (для воды Kк = 1,86 °C·кг/моль). Важно: если вещество диссоциирует (распадается на ионы), эффективное количество частиц увеличивается пропорционально числу ионов.
| Растворенное вещество | Концентрация (1 моляльная) | ΔTзам., °С (приблиз.) |
| Глюкоза (неэлектролит) | 1 моль/кг воды | -1.86 |
| NaCl (сильный электролит) | 1 моль/кг воды | -3.72 (≈ 2 × 1.86) |
Таким образом, сам механизм кристаллизации требует чистой поверхности кристалла из молекул воды. Любые посторонние частицы, не встраивающиеся в решетку льда, действуют как деструкторы, замедляющие или блокирующие рост кристалла и вынуждающие снижать температуру для начала процесса.
Ионные соединения (соли) как сильнейшие депрессоры точки замерзания
Соли демонстрируют исключительную эффективность в снижении температуры замерзания воды благодаря полной диссоциации в водном растворе на катионы и анионы. Этот процесс кратно увеличивает общее количество частиц в системе по сравнению с исходным молекулярным соединением. Коллигативные свойства растворов, включая депрессию точки замерзания, напрямую зависят от моляльной концентрации всех растворённых частиц, а не от их химической природы.
Эффективность соли как депрессора определяется количеством ионов, образующихся при диссоциации одной молекулы вещества – ионной силой раствора. Хлорид натрия (NaCl), диссоциирующий на два иона (Na⁺ и Cl⁻), снижает температуру замерзания вдвое сильнее, чем эквимолярный раствор неэлектролита (например, сахара). Хлорид кальция (CaCl₂), распадающийся на три иона (Ca²⁺ и два Cl⁻), проявляет примерно втрое больший депрессирующий эффект при той же моляльной концентрации.
Ключевые факторы влияния солей:
- Степень диссоциации: при 100% диссоциации эффективность приближается к теоретическому максимуму.
- Ионная сила: соединения с многозарядными ионами (Ca²⁺, SO₄²⁻) оказывают более сильное воздействие из-за электростатических взаимодействий.
- Концентрация: защита от замерзания растёт пропорционально моляльной концентрации всех ионов.
На практике это позволяет использовать солевые растворы для антиобледенения: смесь NaCl с водой замерзает при -21°C (23.3% масс.), а раствор CaCl₂ – ниже -50°C (30% масс.). Реальные значения могут незначительно отклоняться из-за активности ионов и гидратации.
Влияние хлорида натрия на образование ледяной структуры
Хлорид натрия, растворяясь в дистиллированной воде, диссоциирует на ионы Na⁺ и Cl⁻, которые активно взаимодействуют с молекулами H₂O. Эти ионы нарушают упорядоченное формирование водородных связей, необходимое для построения гексагональной кристаллической решётки чистого льда.
Проникновение ионов в межмолекулярное пространство создаёт энергетический барьер для кристаллизации, снижая температуру замерзания раствора. Концентрация соли напрямую определяет степень угнетения кристаллообразования: каждые 5% NaCl понижают точку замерзания примерно на 2.8°C, достигая минимума (-21.1°C) при эвтектической концентрации 23.3%.
Структурные дефекты льда
При замерзании солевого раствора возникают два ключевых феномена:
- Инклюзии рассола: несмотря на перекристаллизацию, часть ионных кластеров захватывается растущим льдом, образуя микрополости с жидким рассолом;
- Дефекты кристаллической решётки: ионы вызывают деформацию водородных связей, увеличивая количество точечных дефектов и дислокаций.
Визуально это проявляется как мутность и снижение механической прочности льда, поскольку:
- Размер кристаллов сокращается из-за множественных центров нуклеации;
- Газопроницаемость повышается на 15-30% относительно чистого льда;
- Целостность решётки нарушается хаотично ориентированными доменами.
| Концентрация NaCl | Температура замерзания (°C) | Прочность льда (отн. ед.) |
|---|---|---|
| 0% | 0.0 | 1.00 |
| 5% | -2.8 | 0.85 |
| 15% | -10.6 | 0.62 |
| 23.3% | -21.1 | 0.41 |
Эффект от присутствия пищевой соды (бикарбоната натрия) в воде
Пищевая сода (NaHCO₃) при растворении в воде диссоциирует на ионы натрия (Na⁺) и гидрокарбоната (HCO₃⁻), что увеличивает общее количество частиц в растворе. Этот процесс формирует коллигативное свойство, при котором температура замерзания жидкости снижается пропорционально концентрации растворённых компонентов. Каждая ионная частица нарушает упорядоченное формирование кристаллической решётки льда, требуя больших охлаждающих усилий для перехода в твёрдую фазу.
Степень снижения температуры замерзания (ΔTкрист) зависит от моляльной концентрации соды и описывается формулой: ΔTкрист = i × Kf × m, где Kf – криоскопическая константа воды (1,86 °C·кг/моль), m – моляльная концентрация, а i – коэффициент Вант-Гоффа. Для раствора NaHCO₃ i ≈ 1.7–1.9 (из-за частичной ассоциации ионов), на практике дающий меньший эффект, чем у солей с полной диссоциацией. Таким образом, вода с добавлением соды замерзает при температурах ниже 0°C.
- Концентрационные эффекты: Раствор с 5%-й массовой долей пищевой соды (∼0.6 моль/кг) снижает температуру замерзания примерно до -2.0°C.
- Парадокс перенасыщения: При высоких концентрациях (более 8%) часть соды не растворяется, ограничивая максимальный эффект охлаждения до -4°C-4.5°C.
- Границы применимости: Использование для антиобледенения экономически менее выгодно, чем соль (NaCl), из-за более высокой молярной массы и меньшего значения i.
| Концентрация NaHCO₃ | ΔTкрист (°C) | Температура замерзания (°C) |
|---|---|---|
| 1% (0.12 моль/кг) | -0.4 | -0.4 |
| 3% (0.36 моль/кг) | -1.2 | -1.2 |
| 5% (0.60 моль/кг) | -2.0 | -2.0 |
Действие сахарозы: снижение температуры замерзания растворов
Сахароза, как неэлектролит, при растворении в воде не диссоциирует на ионы, а сохраняется в виде цельных молекул. Каждая молекула сахара создаёт физическое препятствие для формирования упорядоченной кристаллической решётки льда, требуя дополнительного понижения температуры для преодоления этого сопротивления. Чем выше концентрация раствора, тем сильнее нарушается процесс кристаллизации.
Понижение температуры замерзания (ΔT) прямо пропорционально моляльной концентрации раствора и рассчитывается по формуле: ΔT = Kf · m · i, где Kf – криоскопическая постоянная воды (1,86 °C·кг/моль), m – моляльность (моль/кг), i – изотонический коэффициент. Для сахарозы i=1, так как она не диссоциирует. Например, раствор с 1 моль/кг сахарозы замерзает при -1.86°C, а при 10% концентрации – около -0.6°C.
Алкогольные примеси: этиловый спирт в водной среде
Этиловый спирт (C2H5OH) при растворении в воде существенно снижает температуру её замерзания. Чистая дистиллированная вода кристаллизуется при 0°C, однако добавление даже небольшого объёма этанола нарушает упорядоченное формирование кристаллической решётки льда. Молекулы спирта, взаимодействуя с водой через водородные связи, препятствуют образованию стабильных ледяных структур.
Степень снижения температуры замерзания прямо пропорциональна концентрации этанола в растворе. Данная зависимость описывается формулой ΔTз = Kf · m · i, где Kf – криоскопическая постоянная воды (1.86 °C·кг/моль), m – моляльная концентрация, i – изотонический коэффициент (для этанола ≈1.0). Например, раствор с 10% массовой долей спирта замерзает при -4.5°C, а 40%-ный раствор – уже при -27°C.
Факторы влияния этилового спирта
- Дисперсия молекул: Этанол встраивается между молекулами H2O, требуя большего переохлаждения для начала кристаллизации.
- Давление пара: Повышение давления пара раствора уменьшает разницу между жидкой и твёрдой фазами, затрудняя замерзание.
- Концентрационная зависимость: Максимальный эффект достигается при соотношении 2:5 (этанол:вода), переводящем замерзание ниже -120°C. Предельные концентрации (>80%) вновь повышают точку замерзания.
| Концентрация этанола (% масс.) | Температура замерзания (°C) |
|---|---|
| 5 | -2.0 |
| 20 | -10.6 |
| 40 | -27.0 |
Органические кислоты и их вклад в понижение точки замерзания
Органические кислоты (например, уксусная, лимонная, щавелевая) диссоциируют в водных растворах, образуя гидратированные ионы Н⁺ и анионы кислотного остатка. Каждая молекула кислоты создает несколько частиц в растворе, а количество частиц – ключевой фактор в понижении точки замерзания согласно коллигативным свойствам растворов.
При добавлении к дистиллированной воде органических кислот происходит более значительное снижение температуры кристаллизации по сравнению с неэлектролитами аналогичной концентрации. Это объясняется их способностью к частичной или полной диссоциации: например, одноосновная уксусная кислота (CH₃COOH → CH₃COO⁻ + H⁺) увеличивает количество частиц в ≈1.002-1.05 раз ориентируясь на константу диссоциации, для трёхосновной лимонной кислоты при полной диссоциации это соотношение достигает 1:4. Ключевые зависимости выражаются через:
- Моляльную концентрацию раствора (m)
- Изотонический коэффициент Вант-Гоффа (i), отражающий степень диссоциации
- Криоскопическую константу воды (1.86 °C·кг/моль)
- Слабые кислоты (уксусная, молочная): i близок к 1 ÷ 2 при низких концентрациях – снижение на 0.5-3°C.
- Сильные кислоты (щавелевая) или полипротонные при высоких концентрациях: i стремится к 2 ÷ 4 – депрессия до 5-7°C.
- Биологические жидкости (соки растений, крови): комплекс кислот усиливает антифризные свойства, предотвращая замерзание при -4°C ÷ -8°C.
| Кислота | Концентрация (моль/кг) | Среднее число частиц (i) | ΔTₚ (°C) |
|---|---|---|---|
| Уксусная | 0.1 | 1.008 | ≈0.188 |
| Лимонная | 0.05 | 1.3 | ≈0.12 |
| Щавелевая | 0.1 | 1.25 | ≈0.233 |
На эффективность диссоциации влияют pH раствора и наличие буферных систем. Так, в кислых средах с pH ниже pKa диссоциация подавлена, а в нейтральных – усиливается. Например, лимонная кислота в цитрусовом соке (pH≈2.5) диссоциирована слабее, чем в разбавленном растворе с pH=5. Этот механизм важно учитывать при прогнозировании криозащиты в пищевых и биотехнологических системах.
Роль минеральных примесей из водопроводной воды
Минеральные примеси в водопроводной воде – такие как ионы кальция (Ca²⁺), магния (Mg²⁺), натрия (Na⁺), хлора (Cl⁻) и гидрокарбонатов (HCO₃⁻) – действуют как электролиты. Они диссоциируют на заряженные частицы в растворе, снижая температуру замерзания воды по сравнению с дистиллированной. Этот эффект подчиняется коллигативным свойствам растворов: количество растворённых частиц прямо влияет на степень депрессии замерзания.
Чем выше концентрация ионов, тем сильнее сдвиг точки замерзания. Например:
- Вода с жёсткостью 5–6 мг-экв/л замерзает при –0.2°C…–0.5°C.
- Морская вода (солёность 3.5%) кристаллизуется при около –2°C из-за высокой доли NaCl и MgCl₂.
Диссоциация солей и температурный сдвиг
| Вещество | Пример формулы | Типичный ∆T (°C) при 0.1 моль/кг |
|---|---|---|
| Хлорид натрия | NaCl → Na⁺ + Cl⁻ | ∼ –0.36 |
| Сульфат магния | MgSO₄ → Mg²⁺ + SO₄²⁻ | ∼ –0.19 |
| Карбонат кальция | CaCO₃ → Ca²⁺ + CO₃²⁻ | ∼ –0.23 |
Глицерин как типичная добавка-антифриз
Глицерин (пропантриол) существенно понижает температуру замерзания дистиллированной воды, классифицируясь как эффективный криопротектор. Это происходит за счет нарушения способности молекул воды образовывать упорядоченную кристаллическую решетку льда. Молекулы глицерина взаимодействуют с водой посредством водородных связей, увеличивая энтропию системы и затрудняя процесс нуклеации.
Степень снижения точки замерзания напрямую зависит от концентрации глицерина в растворе. Принцип опирается на коллигативные свойства растворов, где ключевым фактором выступает количество частиц растворенного вещества. Каждая молекула тригидроксильного спирта создает гидратную оболочку, изолируя воду от участия в формировании монолитного льда.
Предсказать температурный сдвиг можно с помощью уравнения: ΔTf = Kf × i × m, где:
- ΔTf — понижение температуры замерзания (°C)
- Kf — криоскопическая постоянная воды (1.86 °C·кг/моль)
- i — изотонический коэффициент (для глицерина ≈1, так как он не диссоциирует)
- m — моляльная концентрация (моль/кг)
Примеры эффекта при разных концентрациях:
| Массовая доля глицерина | Приблизительная T замерзания |
|---|---|
| 20% | -4.5°C |
| 40% | -15°C |
| 60% | -38°C |
Примечание: Значения могут варьироваться в зависимости от чистоты компонентов и скорости охлаждения.
Расчет степени депрессии по формуле Рауля

Формула Рауля количественно связывает величину понижения температуры замерзания раствора (степень депрессии ΔT) с его концентрацией. Для разбавленных растворов неэлектролитов эта зависимость выражается следующим образом:
Основное уравнение формулы Рауля: ΔT = Kк × m. Здесь ΔT – это понижение температуры замерзания (депрессия) относительно температуры замерзания чистого растворителя (для воды 0 °C). Kк – криоскопическая константа растворителя, специфичная для каждого вещества. Для воды Kк ≈ 1.86 °C·кг/моль. m – моляльная концентрация раствора, выраженная в молях растворенного вещества на килограмм растворителя (моль/кг).
Для практического расчета депрессии точки замерзания воды с растворенными неэлектролитами, формулу используют в виде:
ΔT = 1.86 × m.
Если известны масса растворенного вещества (gв-ва в граммах), его молярная масса (Mв-ва в г/моль) и масса растворителя (воды, mH₂O в килограммах), моляльность расчета проводят как:
m = gв-ва / (Mв-ва × mH₂O),
а затем подставляют полученное значение `m` в формулу Рауля, чтобы определить ΔT. Формула также позволяет рассчитать молярную массу растворенного вещества по экспериментально измеренной депрессии (Mв-ва = (Kк × gв-ва) / (ΔT × mH₂O)).
- ΔT (Депрессия): Измеряемое понижение температуры замерзания (°C).
- Kк (Криоскопическая константа): Экспериментальная константа для воды, равная 1.86 °C·кг/моль.
- m (Моляльность): Концентрация, рассчитываемая как число молей растворенного вещества на килограмм растворителя (воды), не раствора (моль/кг).
Зависимость эффекта от концентрации растворенного вещества
Величина понижения температуры замерзания (ΔT) линейно пропорциональна моляльной концентрации нелетучего растворенного вещества согласно формуле ΔT = Kf · m, где Kf – криоскопическая константа воды (1,86 °C·кг/моль), а m – моляльность раствора (моль/кг). Эта зависимость известна как коллигативное свойство раствора, поскольку она зависит исключительно от количества частиц растворенного вещества, а не от их химической природы при условии отсутствия электростатических взаимодействий между ними.
Для электролитов линейная зависимость сохраняется при низких концентрациях (обычно ниже 0,1 моль/кг), но с поправкой на фактор Вант-Гоффа (i): ΔT = i · Kf · m. Значение i отражает количество диссоциированных ионов на одну формульную единицу вещества: например, i=2 для NaCl (Na+ + Cl−), а i=3 для CaCl2. При этом отклонения от идеализированного поведения наблюдаются при дебаевской длине экранирования, характерной для данного раствора.
Ключевые закономерности
- Суперпозиция эффектов: При наличии нескольких примесей величины ΔT от каждой добавки суммируются алгебраически
- Критическая точка насыщения: Максимальное ΔT наблюдается перед началом кристаллизации самого растворенного вещества, когда раствор становится насыщенным
- Пределы применимости: Для концентрированных растворов (>1 моль/кг) уравнение требует модификации из-за:
- Изменения активности растворителя
- Увеличения вязкостных эффектов
- Образования гидратных комплексов
| Тип вещества | Концентрация | Характер зависимости |
|---|---|---|
| Неэлектролиты | 0–0,5 моль/кг | Строго линейная |
| Сильные электролиты | 0–0,1 моль/кг | Линейная с i-коррекцией |
| Слабые электролиты | Весь диапазон | Нелинейная из-за диссоциационного равновесия |
Экспериментальные данные показывают, что при концентрациях выше 20 масс.% отклонения от линейной теории могут достигать 15-30%, что требует применения уравнений Питцера или аналогичных моделей, учитывающих коэффициенты активности.
Эксперимент с морской водой: практическая демонстрация
Для сравнения температур замерзания дистиллированной и морской воды подготовьте два одинаковых контейнера. Налейте в первый 200 мл дистиллированной воды, во второй – 200 мл натуральной морской воды (средняя солёность 35 г/л). Разместите ёмкости в морозильной камере, стабилизированной на -10°C. Используйте цифровые термометры с погрешностью ±0.1°C для непрерывной фиксации температуры в каждой ёмкости. Эксперимент начните при комнатной температуре.
При достижении 0°C в дистиллированной воде наблюдается образование кристаллов льда. Морская вода продолжает охлаждаться без кристаллизации до достижения точки -1.9°C (±0.1°C), что визуально подтверждается помутнением и формированием ледяных игл. Разница возникает из-за нарушения ионами Na⁺ и Cl⁻ формирования кристаллической решётки льда: чем выше концентрация солей, тем сильнее понижение температуры замерзания согласно закону Рауля.
Контрольные показатели эксперимента:
| Параметр | Дистиллированная вода | Морская вода |
|---|---|---|
| Начало кристаллизации | 0.0°C | -1.9°C |
| Полное замерзание | -1.2°C | -3.5°C |
Ключевые наблюдения:
- Лёд из морской воды имеет слоистую структуру и рыхлую консистенцию из-за вытеснения солей в незамёрзшие зоны
- Термограмма показывает плато на графике температуры морской воды при -1.9°C – фаза перехода сопровождается выделением теплоты кристаллизации
- После удаления льда оставшийся рассол имеет солёность до 100 г/л
Данный эксперимент наглядно демонстрирует практическое влияние солей на температуру фазового перехода. Для арктического судоходства или аквакультуры критически важно предсказывать точки замерзания воды при разной солёности. Например, в Балтийском море (солёность 7 г/л) кристаллизация начинается при -0.4°C, тогда в Мёртвом море (340 г/л) – только при -21°С.
Поведение коллоидных взвесей при охлаждении
Коллоидные взвеси, представляющие собой системы с частицами размером 1–1000 нм, диспергированными в жидкой фазе, демонстрируют специфические термодинамические эффекты при понижении температуры. Адсорбционные слои стабилизаторов (ионов, поверхностно-активных веществ или полимеров) на поверхности коллоидных частиц формируют защитный барьер, препятствующий коагуляции при стандартных условиях. Однако при охлаждении вязкость дисперсионной среды возрастает, уменьшается кинетическая энергия частиц, а диффузионные процессы замедляются, что нарушает термодинамическое равновесие системы.
Дестабилизация коллоидного раствора сопровождается фазовыми переходами, определяемыми критическими температурами расслоения или гелеобразования. При приближении к температуре замерзания растворителя происходит:
- Сегрегация льда: кристаллизующаяся вода вытесняет коллоидные частицы в межкристаллитные области, концентрируя взвесь, что провоцирует флокуляцию и синерезис
- Криогелирование: в системах с полимерными стабилизаторами формируется макропористая ледяная матрица, темп переохлаждения влияет на размер пор и прочность
- Нарушение сольватных оболочек: снижение температуры ослабляет гидратацию заряженных групп, сокращая электростатическое отталкивание между частицами.
Ключевые параметры, определяющие криостабильность коллоидных систем:
| Фактор | Влияние на замерзание |
|---|---|
| Концентрация частиц | Выше концентрация → больше криофокусирующий эффект |
| Природа стабилизатора | Стереостабилизация полимерами устойчивее к охлаждению, чем DLVO |
| Скорость охлаждения | Медленное → рост крупных кристаллов льда → разрушение структуры |
Влияние частиц глины на замерзание воды
Глиняные частицы действуют как активные центры нуклеации, ускоряя кристаллизацию воды. Они предоставляют поверхность для формирования кристаллических решёток льда, снижая переохлаждение и приближая фактическую температуру начала замерзания ближе к 0°C. В дистиллированной воде без примесей процесс требует больше времени и энергии из-за отсутствия таких центров.
Структура льда существенно нарушается глинистыми включениями. Частицы формируют хаотичные границы кристаллитов, создавая микроскопические прослойки концентрированной примесной жидкости между кристаллами. Это приводит к образованию мутного, хрупкого льда с пониженной прочностью на разрыв и сжатие по сравнению с монолитным прозрачным льдом.
| Параметр | Влияние глины |
|---|---|
| Требуемое переохлаждение | Уменьшается в 2-3 раза |
| Скорость замерзания | Рост на 15-40% |
| Механические свойства | Снижение прочности до 30% |
| Теплопроводность | Уменьшение на 10-25% |
Температурные аномалии при замерзании металлосодержащих растворов
Ионы металлов, такие как железо, медь или алюминий, вызывают нелинейные отклонения в температуре замерзания растворов, нарушая стандартный коллигативный принцип прямолинейной зависимости от концентрации. Это обусловлено образованием специфических гидратных оболочек вокруг катионов, изменяющих структуру кристаллической решётки льда, а также явлениями переохлаждения, когда раствор остаётся жидким значительно ниже нуля градусов из-за затруднённой нуклеации.
Аномально высокая депрессия замерзания характерна для растворов солей с многозарядными ионами (например, FeCl3), где комплексообразование и гидратация повышают энтропийный барьер кристаллизации. И наоборот, некоторые тяжёлые металлы (такие как ртуть) демонстрируют повышение точки замерзания при низких концентрациях из-за поверхностных эффектов на границе раздела фаз, что противоречит классической термодинамике разбавленных растворов.
Ключевые примеры аномалий:
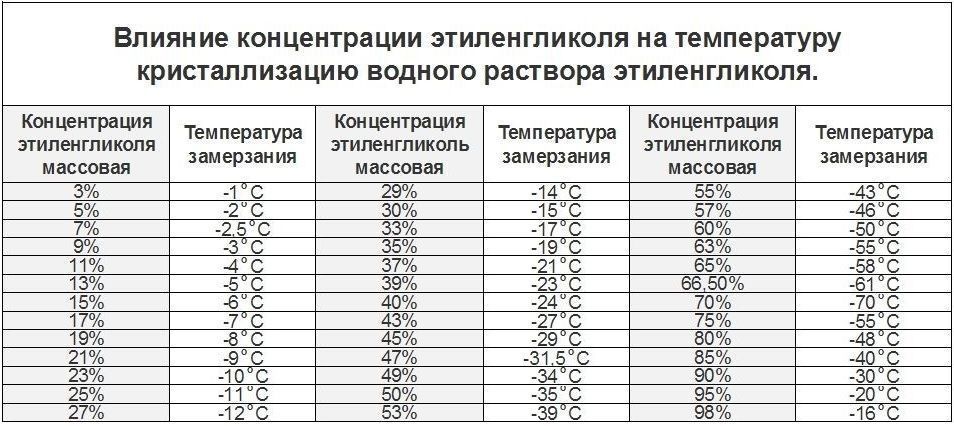
- Железо(III): Раствор FeCl3 (10%) замерзает при −45°C из-за формирования устойчивых аквакомплексов [Fe(H2O)6]3+, препятствующих упорядочиванию воды.
- Медь(II): CuSO4 вызывает гистерезис замерзания до −15°C даже при 5%-ной концентрации вследствие кинетического замедления образования кристаллов.
- Ртуть(I): Hg2(NO3)2 в концентрации 0.1% повышает точку замерзания на 0.3°C из-за адсорбции ионов на поверхности льда.
| Металл | Формула соли | Концентрация | ΔT замерзания |
|---|---|---|---|
| Алюминий | AlCl3 | 5% | −28°C |
| Цинк | ZnBr2 | 15% | −60°C |
Примечание: Анализ данных требует учёта гидратации, вязкости и размера кластеров воды, искажённых присутствием металлов.
Значение pH среды для кристаллизации примесных систем
Изменение pH раствора напрямую влияет на процесс кристаллизации дистиллированной воды с примесями, так как определяет заряд поверхности коллоидных частиц и ионов. При отклонении от нейтральных значений (pH 7) усиливается гидратация примесей или меняется их растворимость, затрудняя формирование стабильных кристаллических решёток. Например, в кислой среде (pH < 3) ионы H+ блокируют активные центры кристаллизации, а в щелочной (pH > 10) повышается концентрация OH−, что нарушает водородные связи и снижает однородность льда.
Влияние pH на температуру замерзания проявляется через несколько механизмов:
- Диссоциация примесей: слабые кислоты/основания изменяют степень ионизации при сдвиге pH, увеличивая количество растворённых частиц, что угнетает кристаллизацию.
- Агрегация взвесей: при изоэлектрической точке (когда заряд частиц равен нулю) примеси легче коагулируют, выступая ядрами кристаллизации, тогда как сильный заряд при экстремальном pH стабилизирует суспензии.
- Состав осадка: в жёсткой воде щелочная среда (pH > 8.3) провоцирует выпадение карбоната кальция, который становится центром льдообразования, сокращая переохлаждение раствора.
Почему газированная вода замерзает при более низких температурах
Температура замерзания чистой дистиллированной воды составляет 0 °C при нормальном атмосферном давлении. Однако растворение в воде любых веществ, включая газы, понижает эту температуру благодаря явлению, называемому депрессией точки замерзания. Газированная вода представляет собой раствор углекислого газа (CO₂) в воде. Именно присутствие растворенного CO₂ является ключевым фактором, смещающим точку ее замерзания вниз по температурной шкале.
В газированной воде растворенный диоксид углерода взаимодействует с молекулами H₂O, частично образуя угольную кислоту (H₂CO₃), которая диссоциирует на ионы: H₂CO₃ ⇌ H⁺ + HCO₃⁻ ⇌ 2H⁺ + CO₃²⁻. Эти ионы, а также сами молекулы CO₂, действуют как "примеси" по двум основным механизмам:
- Коллигативный эффект: Количество растворенных частиц (ионов H⁺, HCO₃⁻, CO₃²⁻, молекул CO₂, H₂O) в газированной воде значительно превышает их количество в чистой воде. Кристаллическая решетка льда может формироваться, только если молекулы воды выстроятся в строгом порядке. Растворенные частицы физически мешают этому упорядоченному процессу, требуя для начала замерзания более низкой температуры, чтобы молекулам воды хватило энергии преодолеть это препятствие.
- Электролитическая диссоциация: Образование ионов угольной кислоты увеличивает общую концентрацию частиц в растворе. Поскольку депрессия точки замерзания прямо пропорциональна общей моляльной концентрации всех растворенных частиц (моляльности), диссоциация на несколько ионов от одной молекулы CO₂ существенно усиливает этот эффект по сравнению с недиссоциирующим веществом той же концентрации.
Степень понижения температуры замерзания зависит от концентрации растворенного CO₂: чем сильнее газирована вода (больше давление CO₂ при розливе), тем ниже точка ее замерзания. Обычная газированная вода под давлением может замерзать при температуре примерно от -2 °C до -5 °C. Этот эффект объясняет, почему бутылка с газировкой, оставленная в морозильной камере дольше, чем обычная вода, может не замерзнуть полностью или замерзнуть при более низкой температуре, а при вскрытии или резком ударе быстро превратиться в лед.
Методы предсказания точки замерзания в многокомпонентных смесях
Прогнозирование температуры замерзания многосоставных растворов требует учета сложных взаимодействий между различными примесями. В отличие от однородных систем, эффекты синергии и антагонизма компонентов приводят к неаддитивному поведению. Термодинамические модели должны интегрировать как коллигативные свойства растворов, так и данные о специфических межмолекулярных силах.
Расчетные подходы варьируются от упрощенных эмпирических формул до строгих прогнозирующих моделей, основанных на фундаментальных физико-химических уравнениях. Выбор метода определяется составом смеси, требуемой точностью и доступными экспериментальными данными о взаимодействии компонентов.
Ключевые подходы к расчету
- Метод мольной доли с коэффициентами активности: Модифицированное уравнение Рауля с использованием коэффициентов активности (γ) для каждого компонента: ΔTf = Kf · Σ(γi · mi). Коэффициенты определяются через модели UNIQUAC или NRTL.
- Молекулярно-динамическое моделирование: Компьютерное моделирование межмолекулярных взаимодействий с прогнозированием кристаллизации. Требует значительных вычислительных ресурсов, но обеспечивает высокую точность для сложных систем.
- Эвтектические диаграммы: Графическое определение температур замерзания на фазовых диаграммах тройных и четверных систем. Эффективно для известных комбинаций солей или спиртов.
- Метод приведенной концентрации: Приведение многокомпонентной смеси к эквиваленту бинарного раствора через экспериментальные поправочные коэффициенты взаимодействия (kij).
| Фактор влияния | Следствие |
|---|---|
| Образование гидратов | Нелинейное снижение Tзам |
| Ионная сила раствора | Рост отклонения от идеальности |
| Размер частиц примесей | Изменение кинетики кристаллизации |
Современные гибридные подходы сочетают уравнения состояния (Пенга-Робинсона, CPA) с групповыми методами UNIFAC. Для промышленных расчетов критически важна валидация моделей экспериментальными данными по реальным смесям.
Практика использования антиобледенительных реагентов на дорогах
Принцип работы большинства антиобледенительных реагентов основан на явлении депрессии точки замерзания раствора: примеси в виде солей понижают температуру, при которой вода переходит в твёрдое состояние. Хлорид натрия (NaCl) предотвращает обледенение до -9°C, хлорид кальция (CaCl₂) – до -50°C, а карбамидно-солевые смеси – до -30°C. Это позволяет разрушать наледь уже при контакте и замедлять повторное замерзание обработанной воды.
Выбор реагента на практике определяется температурным режимом региона, экономическими факторами и экологическими требованиями. Так, дешёвый NaCl доминирует в умеренном климате, но вызывает коррозию металлов и засоление почв. Более эффективные в сильные морозы модифицированные хлориды кальция/магния дороже, но менее агрессивны к бетону и инфраструктуре. Все типы реагентов требуют точного дозирования для минимизации экологического ущерба, особенно вблизи водоёмов и зон с редкими растениями.
Ключевые особенности современных методов

- Предварительная обработка: нанесение раствора до снегопада («мокрый» способ) создаёт защитный слой, сокращая расход материалов на 30%.
- Комбинированные составы: гранитный щебень или песок, добавляемые к реагенту, повышают сцепление колёс с покрытием, но увеличивают объём пыли.
- Экологическая адаптация: применение бишофита вместо технической соли снижает фитотоксичность, а антикоррозионные присадки защищают мосты.
Последствия для пищевой промышленности (заморозка продуктов)
Добавление растворимых веществ (сахар, соль, полиолы) в пищевые продукты снижает температуру замерзания водных компонентов, предотвращая образование крупных кристаллов льда. Это минимизирует повреждение клеточных структур при заморозке, что сохраняет текстуру, предотвращает потерю сока и повышает качество продукции после размораживания. Контроль над размером кристаллов критичен для мяса, фруктов и полуфабрикатов.
Управление точкой замерзания через регулируемое внесение примесей позволяет оптимизировать энергозатраты и выбрать эффективные температурные режимы. Продукты с высоким содержанием природных растворённых веществ (например, мёд или концентрированные сиропы) замерзают при более низких температурах, что требует адаптации технологических линий. Отсутствие таких корректировок приводит к неравномерной кристаллизации и деградации органолептических свойств.
Ключевые эффекты и подходы
- Фрукты и ягоды: Сахара в сиропах понижают точку замерзания на 1–3°C, уменьшая разрыв клеток. Замороженная клубника в сахарном сиропе сохраняет форму лучше, чем без него.
- Мясные изделия: Рассолы с содержанием соли 5–10% предотвращают денатурацию белков, позволяя замораживать при –12°C вместо –18°C.
- Молочные продукты: Сахароза в мороженом (15–20%) снижает температуру фазы льдообразования до –14°C, обеспечивая кремообразную текстуру.
Клиническое значение контроля осмоляльности медицинских растворов
Контроль осмоляльности растворов предотвращает повреждение клеток крови и тканей при инфузиях. Гипотонические жидкости (ниже 280 мосмоль/кг) вызывают набухание и гемолиз эритроцитов из-за осмотического градиента, тогда как гипертонические (выше 300 мосмоль/кг) провоцируют дегидратацию клеток и эндотелиальную травму. Точная изотония (~290 мосмоль/кг) соответствует плазме крови, обеспечивая безопасность введения.
Отклонения критичны для пациентов с нарушенным гомеостазом: при почечной недостаточности гиперосмолярные растворы усугубляют гипернатриемию, а у новорожденных гипоосмолярные инфузии провоцируют отек мозга. Контроль обязателен для парентерального питания, где дисбаланс электролитов и нутриентов изменяет осмотическое давление, влияя на усвоение и системную гидратацию.
- Экстренная медицина: Быстрое введение гипертонических растворов (7.5% NaCl) требует мониторинга осмоляльности для избежания демиелинизации ЦНС.
- Диализ и аптека: Ошибки в приготовлении диализата или инфузионных смесей с отклонениями осмоляльности ведут к фатальным аритмиям.
- Лабораторная диагностика: Осмоляльные разрывы (расхождение между расчетной и измеренной осмоляльностью) выявляют токсины (этанол, метанол).
| Раствор | Осмоляльность (мосмоль/кг) | Риски при нарушении |
|---|---|---|
| 0.9% NaCl | 308 | Гипернатриемия при избытке |
| 5% глюкоза | 278 | Гипонатриемия при массивном введении |
| Маннит 20% | 1098 | Острая почечная недостаточность |
Список источников
При изучении влияния примесей на температуру замерзания дистиллированной воды необходимо опираться на фундаментальные физико-химические принципы и экспериментальные данные. Надежные источники обеспечивают точность информации о депрессии точки замерзания, механизмах кристаллизации и поведении растворов.
Следующие академические и научные работы содержат детальные объяснения эффектов растворенных веществ, включая коллигативные свойства растворов, количественные закономерности и практические примеры изменения температуры фазового перехода воды различными добавками.
Ключевые научные публикации
- Аткинс П., де Паула Дж. "Физическая химия". Том 1. М.: Бином, 2021. Глава 5: "Простая смесь".
- Киреев В.А. "Курс физической химии". М.: Химия, 1975. Раздел: "Свойства растворов".
- Павлов К.Ф. и др. "Примеры и задачи по курсу процессов и аппаратов химической технологии". Л.: Химия, 1987. Задачи на расчет понижения точки замерзания.
- Изгарышев Н.А. "Основы физической химии". М.: Государственное научно-техническое издательство, 1962. Глава IV: "Растворы".
- International Union of Pure and Applied Chemistry (IUPAC). "Compendium of Chemical Terminology. Gold Book". 2019. Термины: "freezing point depression", "colligative properties".
- West, R. "Криоскопия и эбулиоскопия". Journal of Chemical Education. Vol. 56, No. 5, 1979.
