Устройство кислотно-свинцового аккумулятора
Статья обновлена: 28.02.2026
Кислотно-свинцовый аккумулятор – один из старейших и наиболее распространённых типов перезаряжаемых источников тока. Более полутора веков он обеспечивает энергией транспорт, системы связи, промышленное оборудование и резервные системы благодаря своей надёжности и низкой стоимости.
Работа устройства основана на обратимости электрохимической реакции между диоксидом свинца (PbO2) на положительном электроде, чистым свинцом (Pb) на отрицательном электроде и водным раствором серной кислоты (H2SO4). Во время разряда оба электрода превращаются в сульфат свинца (PbSO4), а при заряде – восстанавливаются в исходные вещества.
Роль положительного электрода (диоксид свинца) в реакции
Положительный электрод, изготовленный из диоксида свинца (PbO₂), играет центральную роль в электрохимических процессах кислотно-свинцового аккумулятора. Во время разряда аккумулятора он выступает в качестве катода, где происходит реакция восстановления. Именно здесь принимаются электроны, поступающие по внешней цепи от отрицательного электрода.
PbO₂ вступает в реакцию с серной кислотой (H₂SO₄) и ионами водорода (H⁺), образуя сульфат свинца (PbSO₄) и воду (H₂O). Этот процесс сопровождается выделением электронов во внешнюю цепь при заряде и их потреблением при разряде. Сохранение пористой структуры диоксида свинца критически важно для обеспечения большой площади поверхности реакции и эффективного проникновения электролита.
Ключевые аспекты функционирования положительного электрода
- При разряде (Восстановление): Диоксид свинца (PbO₂) восстанавливается, принимая электроны. Он реагирует с ионами водорода (H⁺) и сульфат-ионами (SO₄²⁻) из электролита, превращаясь в сульфат свинца (PbSO₄) и воду (H₂O). Реакция: PbO₂ + 4H⁺ + SO₄²⁻ + 2e⁻ → PbSO₄ + 2H₂O.
- При заряде (Окисление): Сульфат свинца (PbSO₄) на положительном электроде окисляется под действием внешнего тока, отдавая электроны. Он превращается обратно в диоксид свинца (PbO₂), при этом в электролит выделяются ионы водорода (H⁺) и сульфат-ионы (SO₄²⁻). Реакция: PbSO₄ + 2H₂O → PbO₂ + 4H⁺ + SO₄²⁻ + 2e⁻.
- Источник ЭДС: Разность потенциалов между активными материалами положительного (PbO₂) и отрицательного (Pb) электродов является основным источником электродвижущей силы (ЭДС) аккумулятора.
- Деградация (Сульфатация): Неполный заряд или длительное пребывание в разряженном состоянии приводит к образованию крупнокристаллического сульфата свинца (PbSO₄) на электроде. Этот слой плохо проводит ток и блокирует поры, препятствуя обратимости реакции и снижая емкость.
| Состояние АКБ | Роль Положительного Электрода | Процесс на Электроде | Химическое Превращение | Примечание |
|---|---|---|---|---|
| Разряд | Катод (Восстановление) | Прием электронов | PbO₂ → PbSO₄ | Снижение степени окисления Pb (+4 → +2) |
| Заряд | Анод (Окисление) | Отдача электронов | PbSO₄ → PbO₂ | Повышение степени окисления Pb (+2 → +4); Требует пористости |
Функция отрицательного электрода (чистый свинец) при разряде
При разряде аккумулятора на отрицательном электроде из чистого свинца происходит реакция окисления. Свинец вступает во взаимодействие с сульфат-ионами из электролита, в результате чего образуется нерастворимый сульфат свинца. Этот процесс сопровождается высвобождением электронов, которые перемещаются по внешней цепи к положительному электроду, создавая электрический ток.
Химическое превращение на отрицательном электроде описывается уравнением: Pb + SO₄²⁻ → PbSO₄ + 2e⁻. Образующийся сульфат свинца осаждается на поверхности электрода в виде мелкокристаллического слоя, что приводит к постепенному уменьшению активной площади и снижению напряжения. Одновременно происходит расходование серной кислоты из электролита и уменьшение его плотности.
Ключевые особенности процесса
Электрохимические изменения:
- Металлический свинец (Pb) отдает два электрона, переходя в ионное состояние
- Ионы свинца Pb²⁺ немедленно соединяются с сульфат-ионами SO₄²⁻
Физические последствия:
- Пористая структура электрода заполняется PbSO₄, снижая проводимость
- Увеличивается внутреннее сопротивление элемента
- Объем активной массы возрастает на ~160%
| Параметр | До разряда | После разряда |
|---|---|---|
| Состав электрода | Чистый губчатый Pb | PbSO₄ (белый налет) |
| Плотность электролита | 1.26-1.28 г/см³ | Снижается до 1.10-1.15 г/см³ |
Состав и роль электролита (водный раствор серной кислоты)
Электролит представляет собой водный раствор серной кислоты (H₂SO₄) с концентрацией 30-40% в заряженном состоянии. Плотность раствора составляет 1.26-1.28 г/см³ при +25°C, что обеспечивает оптимальную ионную проводимость. Чистота компонентов критична: примеси (железо, хлор) ускоряют саморазряд и коррозию электродов.
Раствор выполняет двойную функцию: служит источником сульфат-ионов (SO₄²⁻) для электрохимических реакций и средой для переноса ионов между электродами. Концентрация H₂SO₄ напрямую влияет на электропроводность и температуру замерзания (до -70°C для плотности 1.28 г/см³).
Функции и взаимосвязь с состоянием аккумулятора
Ключевые роли электролита в электрохимических процессах:
- Реагент в реакциях: расходуется при разряде, восстанавливается при заряде.
- Перенос заряда: ионы H⁺ движутся к катоду, SO₄²⁻ – к аноду.
- Индикатор заряженности: плотность линейно зависит от степени заряда.
| Состояние АКБ | Плотность (г/см³) | Концентрация H₂SO₄ |
|---|---|---|
| 100% заряда | 1.26-1.28 | 35-40% |
| 50% заряда | 1.20-1.22 | 22-25% |
| 0% заряда (разряжен) | 1.12-1.14 | 14-16% |
Снижение плотности ниже 1.20 г/см³ провоцирует сульфатацию пластин и падение ёмкости. Контроль уровня и плотности обязателен для обслуживаемых АКБ: испарение воды повышает концентрацию кислоты, ускоряя деградацию электродов.
Реакция разряда на положительной пластине
При разряде аккумулятора на положительной пластине происходит восстановление диоксида свинца (PbO2). Активный материал пластины вступает в реакцию с ионами водорода (H+) и сульфат-ионами (SO42-) из электролита. В процессе потребляются электроны, поступающие от внешней цепи через отрицательную пластину.
В результате электрохимического превращения диоксид свинца преобразуется в сульфат свинца (PbSO4). Данная реакция сопровождается выделением молекул воды в электролит. Образующийся сульфат свинца имеет низкую электропроводность и кристаллическую структуру, осаждаясь на поверхности пластины.
Химическое уравнение процесса
Суммарная реакция на положительном электроде при разряде выражается формулой:
PbO2 + 4H+ + SO42- + 2e- → PbSO4 + 2H2O
Ключевые особенности процесса
- Изменение состояния активного вещества: PbO2 (коричневый) → PbSO4 (белый)
- Плотность электролита снижается за счет образования воды и потребления серной кислоты
- Сульфатация пластины уменьшает площадь активной поверхности, ограничивая емкость
| Параметр | До разряда | После разряда |
|---|---|---|
| Материал пластины | PbO2 | PbSO4 |
| Заряд ионов | Потребление 2e- | Нейтральное состояние |
| Роль в цепи | Катод (восстановление) | Электроизолятор |
Реакция разряда на отрицательной пластине
Во время разряда аккумулятора на отрицательной пластине происходит окисление свинца. Металлический свинец (Pb) вступает в реакцию с серной кислотой (H₂SO₄), образуя сульфат свинца (PbSO₄). При этом атомы свинца теряют электроны, которые поступают во внешнюю электрическую цепь.
Химическая реакция описывается уравнением: Pb + H₂SO₄ → PbSO₄ + 2H⁺ + 2e⁻. Образующийся сульфат свинца осаждается на поверхности пластины в виде мелкокристаллического слоя, а ионы водорода (H⁺) переходят в электролит. Этот процесс снижает концентрацию серной кислоты в растворе.
Ключевые аспекты процесса
| Компонент | Исходное состояние | Конечное состояние |
|---|---|---|
| Материал пластины | Губчатый свинец (Pb) | Сульфат свинца (PbSO₄) |
| Электролит | H₂SO₄ (концентрированный) | H₂SO₄ (разбавленный) |
| Электрические изменения | Нейтральный заряд | Высвобождение электронов (2e⁻) |
Важные следствия реакции:
- Пористая структура губчатого свинца обеспечивает большую площадь поверхности для реакции
- Образование PbSO₄ сопровождается увеличением объема активной массы
- Электроны поступают на клемму "минус", создавая ток во внешней цепи
Образование сульфата свинца при разрядке
При разрядке кислотно-свинцового аккумулятора на электродах протекают электрохимические реакции, приводящие к образованию сульфата свинца (PbSO4). На аноде происходит окисление свинца: металлический свинец (Pb) реагирует с серной кислотой (H2SO4), теряя электроны и образуя сульфат свинца и ионы водорода. Параллельно на катоде оксид свинца (PbO2) восстанавливается, также взаимодействуя с электролитом с образованием PbSO4.
Эти процессы сопровождаются потреблением серной кислоты и выделением воды, что снижает плотность электролита. Образующийся сульфат свинца создает мелкокристаллический слой на поверхности электродов. Кристаллы PbSO4 обладают низкой электропроводностью и изолируют активную массу электродов, что постепенно уменьшает емкость аккумулятора. Скорость и равномерность сульфатации напрямую влияют на глубину разряда и срок службы батареи.
Ключевые особенности процесса
- Реакция на аноде: Pb + H2SO4 → PbSO4 + 2H+ + 2e−
- Реакция на катоде: PbO2 + H2SO4 + 2H+ + 2e− → PbSO4 + 2H2O
- Суммарное уравнение: Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
| Параметр | Влияние на аккумулятор |
|---|---|
| Размер кристаллов PbSO4 | Мелкокристаллическая форма при нормальной разрядке обратима, крупные кристаллы вызывают сульфатацию |
| Концентрация H2SO4 | Снижение плотности электролита ниже 1.24 г/см³ ускоряет образование стабильного PbSO4 |
| Температура | При −20°C скорость сульфатации возрастает в 3-4 раза |
Обратимость реакции сульфатообразования критична для работы аккумулятора: при зарядке PbSO4 преобразуется обратно в Pb и PbO2. Однако глубокий разряд или длительное хранение в разряженном состоянии вызывают рекристаллизацию сульфата свинца. Крупные нерастворимые кристаллы PbSO4 блокируют поры активной массы, необратимо снижая емкость.
Обратимость реакций при зарядке
При пропускании через разряженный аккумулятор внешнего постоянного тока в направлении, противоположном разрядному процессу, электрохимические реакции начинают протекать в обратном направлении. Это обеспечивает восстановление исходных активных материалов на электродах.
На катоде (положительный электрод) происходит окисление сульфата свинца (PbSO4) до диоксида свинца (PbO2), а на аноде (отрицательный электрод) сульфат свинца восстанавливается до чистого свинца (Pb). Одновременно увеличивается концентрация серной кислоты в электролите за счет регенерации H2SO4.
Ключевые особенности обратимости
Электрохимическая основа: Обратимость возможна благодаря тому, что обе реакции (разряд и заряд) являются термодинамически и кинетически обратимыми при соблюдении правильных условий.
Условия обеспечения полной обратимости:
- Контроль зарядного тока и напряжения (предотвращение перезаряда)
- Поддержание оптимальной температуры электролита (15-25°C)
- Использование рекомендованных зарядных устройств
- Отсутствие глубокой сульфатации электродов
| Электрод | Реакция при зарядке | Продукты |
|---|---|---|
| Анод (-) | PbSO4 + 2e- + 2H+ → Pb + H2SO4 | Свинец (Pb) |
| Катод (+) | PbSO4 + 2H2O → PbO2 + H2SO4 + 2H+ + 2e- | Диоксид свинца (PbO2) |
Побочные процессы: При превышении напряжения зарядки (>2.4В на элемент) начинается электролиз воды с выделением кислорода на положительном электроде и водорода на отрицательном, что снижает КПД и требует долива дистиллированной воды.
Восстановление диоксида свинца на аноде при заряде
При пропускании зарядного тока через аккумулятор на положительном электроде (аноде) протекает электрохимическая реакция восстановления диоксида свинца (PbO2). Электроны, поступающие от внешнего источника питания, взаимодействуют с PbO2 и ионами водорода (H+) из электролита, что приводит к образованию сульфата свинца (PbSO4) и воды. Эта реакция является обратной процессу разряда и восстанавливает исходное активное вещество анода.
Химически процесс описывается уравнением: PbO2 + SO42- + 4H+ + 2e- → PbSO4 + 2H2O. Ключевые условия протекания реакции включают достаточное напряжение заряда (превышающее ЭДС аккумулятора), оптимальную концентрацию серной кислоты (порядка 30-40%) и температуру электролита в диапазоне 20-25°C.
Особенности процесса

- Скорость восстановления зависит от плотности тока: высокие значения ускоряют процесс, но могут вызвать перегрев и коррозию решётки.
- Неполное восстановление PbO2 приводит к необратимой сульфатации – образованию крупнокристаллического PbSO4, не участвующего в реакциях.
- Побочные реакции (например, электролиз воды с выделением кислорода) начинаются при превышении напряжения заряда выше 2.4 В на элемент.
| Параметр | Влияние на восстановление PbO2 |
|---|---|
| Конечное напряжение заряда | Должно достигать 2.35–2.45 В для полного преобразования PbSO4 |
| Состояние электрода | Разрушение решётки или отслоение активной массы снижают эффективность |
| Примеси в электролите | Ионы хлора или железа ускоряют саморазряд и коррозию |
Восстановление губчатого свинца на катоде при заряде
При подаче зарядного тока на катоде аккумулятора происходит электрохимическое восстановление. Ионы свинца Pb²⁺ из электролита принимают электроны и осаждаются на электроде, формируя металлический свинец. Этот процесс представляет собой обратную реакцию разрядного цикла.
Образовавшийся свинец имеет высокопористую губчатую структуру с развитой поверхностью. Такая морфология критична для обеспечения эффективного контакта с электролитом и протекания последующих реакций при разряде. Параллельно в электролите повышается концентрация серной кислоты.
Ключевые особенности процесса
Химическая реакция на катоде описывается уравнением:
PbSO4(тв) + 2e– + 2H+ → Pb(тв) + H2SO4
Условия, необходимые для корректного восстановления:
- Подача внешнего напряжения выше ЭДС аккумулятора (~2.05 В/элемент)
- Контроль плотности электролита (1.28 г/см³ при полном заряде)
- Температурный диапазон +15°C...+25°C
Критические факторы, влияющие на качество губчатого слоя:
| Фактор | Оптимальное значение | Последствия отклонений |
|---|---|---|
| Скорость заряда | 0.1C (10% от ёмкости) | При перезаряде - коррозия решёток |
| Чистота свинца | >99.9% | Примеси снижают пористость |
| Состояние сульфата | Мелкокристаллический PbSO4 | Крупные кристаллы не восстанавливаются |
Губчатая структура обеспечивает удельную поверхность до 0.5 м²/г, что в 50 раз превышает геометрическую площадь электрода. Это позволяет достигать плотностей тока до 200 мА/см² без поляризации.
Концентрация электролита как индикатор состояния батареи
Концентрация серной кислоты в электролите напрямую отражает уровень заряда свинцово-кислотного аккумулятора. В процессе разряда ионы SO₄²⁻ расходуются на образование сульфата свинца на пластинах, снижая плотность раствора. При заряде происходит обратная реакция: сульфат распадается, высвобождая кислоту в электролит, что повышает его концентрацию.
Плотность электролита измеряется ареометром при температуре +25°C. Нормальные значения варьируются в зависимости от типа АКБ и производителя, но для полностью заряженной батареи составляют 1.26-1.28 г/см³. Отклонения от этих показателей свидетельствуют о проблемах:
Интерпретация показателей плотности
| Плотность (г/см³) | Состояние батареи | Возможные причины |
| 1.25-1.28 | Нормальный заряд (80-100%) | Исправное состояние |
| 1.20-1.24 | Частичный разряд (50-80%) | Необходима подзарядка |
| 1.15-1.19 | Глубокий разряд (20-50%) | Риск сульфатации пластин |
| 1.10-1.14 | Критический разряд (<20%) | Немедленная зарядка |
Ключевые закономерности:
- Падение плотности на 0.01 г/см³ соответствует потере ~5-6% заряда
- Разница плотности между банками >0.03 г/см³ указывает на неисправность элемента
- Невозможность восстановления номинальной плотности после зарядки сигнализирует о:
- Сульфатации пластин (белый налет сульфата свинца)
- Потере активной массы электродов
- Замыкании пластин
Эксплуатационные требования: Корректировка уровня электролита производится только дистиллированной водой при полном заряде АКБ. Доливка кислоты разрешается исключительно при подтверждённом выплескивании раствора, так как произвольное увеличение концентрации ускоряет коррозию решёток и сокращает ресурс батареи.
Выделение газов (кислород, водород) при перезаряде
При достижении полного заряда АКБ продолжение подачи тока приводит к перезаряду. На этом этапе основная реакция восстановления сульфата свинца завершена, и избыточная энергия направляется на побочные процессы.
Электролит (водный раствор серной кислоты) подвергается электролизу. На положительном электроде (PbO2) происходит окисление воды с выделением кислорода, а на отрицательном (Pb) – восстановление ионов H+ с образованием водорода.
Химические реакции электролиза
На аноде:
2H2O → O2↑ + 4H+ + 4e-
На катоде:
4H+ + 4e- → 2H2↑
Ключевые последствия газовыделения:
- Снижение уровня электролита из-за расхода воды
- Образование взрывоопасной гремучей смеси (H2:O2 = 2:1)
- Коррозия решеток электродов
- Повышенное давление внутри корпуса
Для минимизации рисков применяют:
- Зарядные устройства с автоматическим отключением
- Контроль напряжения заряда (не выше 2.4 В/элемент)
- Специальные пробки с каталитическими колпачками для рекомбинации газов
| Газ | Электрод | Объем на 1 А·ч перезаряда |
| Кислород (O2) | Анод (+) | 0.21 л |
| Водород (H2) | Катод (-) | 0.42 л |
Влияние температуры на скорость электрохимических процессов
Повышение температуры электролита в свинцово-кислотном аккумуляторе интенсифицирует электрохимические реакции на электродах. Это объясняется увеличением кинетической энергии ионов и молекул, что снижает энергию активации процессов разряда-заряда и ускоряет диффузию активных веществ к поверхности электродов.
Обратный эффект наблюдается при охлаждении: снижение температуры замедляет ионный перенос и химические превращения. При температурах ниже 0°C вязкость электролита резко возрастает, а растворимость сульфата свинца уменьшается, что приводит к падению ёмкости и ухудшению приемки заряда.
Ключевые закономерности
- Температурная компенсация напряжения: Напряжение заряда должно снижаться при нагреве (на ~3 мВ/°С на элемент) для предотвращения перезаряда
- Эмпирическое правило: Падение температуры на 10°C снижает отдаваемую ёмкость на 15-20%
- Экстремальные условия:
- Выше +50°C: Ускорение коррозии решёток положительного электрода
- Ниже -20°C: Риск замерзания электролита и механического повреждения пластин
| Температура (°C) | Относительная ёмкость (%) | Скорость саморазряда |
|---|---|---|
| +40 | 105-110 | 200% от номинала |
| +25 | 100 | Номинальная |
| 0 | 80-85 | 40% от номинала |
| -20 | 60-65 | 5% от номинала |
Термоциклирование (периодические нагревы/охлаждения) провоцирует расслоение электролита и ускоренную сульфатацию. Для компенсации температурных эффектов применяют:
- Теплоизоляцию банок в критических условиях
- Активные системы термостабилизации
- Модификации электролита (гелеобразные или абсорбированные составы)
Саморазряд: причины и факторы влияния
Саморазряд кислотно-свинцового аккумулятора – это самопроизвольная потеря ёмкости при разомкнутой цепи вследствие паразитных электрохимических процессов. Данное явление неизбежно даже при хранении нового аккумулятора и обусловлено термодинамической нестабильностью электродных материалов в сернокислотном электролите.
Интенсивность саморазряда зависит от конструктивных особенностей аккумулятора, качества материалов и внешних условий. Высокая скорость саморазряда сокращает срок службы батареи и требует периодической подзарядки для компенсации потерь.
Основные причины саморазряда
Химические реакции на электродах:
- Отрицательный электрод (Pb): Растворение свинца в электролите с выделением водорода: Pb + H2SO4 → PbSO4 + H2↑. Ускоряется примесями (сурьма, мышьяк).
- Положительный электрод (PbO2): Восстановление диоксида свинца: 2PbO2 + 2H2SO4 → 2PbSO4 + 2H2O + O2↑. Катализируется примесями марганца или железа.
Электрохимические факторы:
- Локальные микро-короткие замыкания через дендриты свинца или шлам на дне корпуса.
- Неоднородность поверхности электродов, создающая разность потенциалов.
Факторы, влияющие на скорость саморазряда
| Фактор | Влияние |
|---|---|
| Температура | Рост на 10-15°C удваивает скорость реакций |
| Плотность электролита | Повышение плотности усиливает коррозию решёток |
| Чистота материалов | Примеси (Fe, Cu, Mn) катализируют реакции |
| Возраст аккумулятора | Увеличивается из-за сульфатации и коррозии |
| Конструкция сепаратора | Барьерные свойства снижают миграцию ионов |
Методы минимизации: Использование высокочистого свинца, легирование кальцием вместо сурьмы, герметизация клемм для предотвращения утечек тока по поверхности электролита, соблюдение режимов хранения (+5...15°C).
Сульфатация пластин и её последствия для ёмкости

Сульфатация пластин представляет собой процесс образования крупнокристаллического сульфата свинца (PbSO4) на поверхности электродов во время разряда аккумулятора. В нормальных условиях этот сульфат мелкокристаллический и легко преобразуется обратно в активные материалы (Pb и PbO2) при последующем заряде. Однако при неблагоприятных условиях эксплуатации кристаллы PbSO4 укрупняются и становятся электрохимически неактивными.
Ключевыми причинами сульфатации являются: глубокие разряды (ниже 20% ёмкости), длительное хранение в разряженном состоянии, систематический недозаряд, эксплуатация при высоких температурах (+45°C и более), а также естественное старение батареи. Крупные кристаллы сульфата блокируют поры активной массы, снижая доступ электролита к внутренним слоям пластин.
Влияние сульфатации на характеристики аккумулятора
Последствия необратимой сульфатации проявляются в нескольких аспектах:
- Снижение доступной ёмкости: Укрупнённые кристаллы PbSO4 не участвуют в обратных электрохимических реакциях, сокращая количество активного материала. Потеря ёмкости может достигать 30-50%.
- Увеличение внутреннего сопротивления: Сульфатный слой создаёт барьер для ионов SO42-, затрудняя протекание тока. Это проявляется в резком падении напряжения под нагрузкой.
- Ускоренная деградация: Забитые поры пластин приводят к механическим напряжениям и разрушению активной массы, особенно на положительных электродах.
- Сложности при зарядке: Аккумулятор быстрее достигает высокого напряжения "кипения", но не набирает номинальную ёмкость. Наблюдается повышенный саморазряд.
Процесс считается частично обратимым на ранних стадиях с помощью десульфатирующих зарядов (подача импульсов тока или поддержание напряжения 2,4–2,5В/банку при малой силе тока). При сильной сульфатации восстановление невозможно – пластины теряют механическую прочность, а ёмкость падает необратимо.
| Стадия сульфатации | Признаки | Потеря ёмкости |
|---|---|---|
| Начальная | Белый налёт на кромках пластин | До 15% |
| Средняя | Серые пятна по всей поверхности, нагрев при зарядке | 15–30% |
| Критическая | Сплошной слой кристаллов, деформация пластин | Более 30% |
Конструкция решёток электродов для прочности и проводимости
Решётки электродов в свинцово-кислотных аккумуляторах выполняют двойную функцию: служат механической основой для активной массы и обеспечивают электронный токообмен между электролитом и внешней цепью. Их конструкция напрямую влияет на механическую устойчивость электродов при вибрациях, срок службы батареи и минимальное внутреннее сопротивление.
Для оптимизации этих параметров применяются специальные инженерные решения в геометрии решёток. Радиальная или диагональная ориентация рёбер жёсткости снижает риск коробления при циклировании и повышает ударную стойкость. Увеличение числа соединительных мостиков между вертикальными элементами усиливает каркас, но требует баланса с объёмом, выделяемым под активное вещество.
Ключевые аспекты конструкции
Материалы и сплавы:
- Чистый свинец (Pb) обладает высокой коррозионной стойкостью, но недостаточной твёрдостью.
- Сплавы с сурьмой (Sb, 1-6%) повышают прочность и литейные свойства, но ускоряют саморазряд.
- Кальциевые сплавы (Pb-Ca) снижают газовыделение и саморазряд, однако чувствительны к глубоким разрядам.
- Комбинированные сплавы (Pb-Ca-Sn) с добавкой олова улучшают смачиваемость и токоотдачу.
Топологические особенности:
| Элемент конструкции | Цель оптимизации | Эффект |
|---|---|---|
| Утолщённые вертикальные рёбра | Снижение электрического сопротивления | Улучшение токопроводящих путей к токоотводу |
| Горизонтальные перемычки переменного сечения | Распределение механических напряжений | Предотвращение трещин при термоциклировании |
| Асимметричное расположение ячеек | Компенсация усадки сплава | Снижение деформации при затвердевании отливки |
Технологические приёмы:
- Рифление поверхности рёбер для увеличения площади контакта с активной массой.
- Нанесение коррозионно-стойких покрытий (например, оксидных плёнок) на зоны повышенного электрохимического износа.
- Использование решёток с градиентной толщиной: утолщение к токоотводу для снижения омических потерь.
Назначение сепараторов между пластинами
Сепараторы в кислотно-свинцовом аккумуляторе представляют собой пористые электроизоляционные материалы, физически разделяющие положительные и отрицательные пластины. Их основная задача – предотвратить непосредственный контакт разноименных электродов, который привел бы к короткому замыканию и саморазряду батареи.
Ключевые функции сепараторов выходят за рамки простого физического барьера. Они обеспечивают свободную миграцию ионов электролита между пластинами через свою пористую структуру, поддерживая электрохимические реакции во время заряда и разряда. Одновременно сепараторы удерживают активную массу пластин от осыпания и выравнивают механические напряжения внутри элемента.
Конструктивные и эксплуатационные требования
- Химическая стойкость: Должны выдерживать агрессивную сернокислотную среду и окислительное воздействие при высоких потенциалах.
- Микроструктура: Контролируемый размер пор предотвращает проникновение частиц активной массы и рост дендритов свинца.
- Механическая прочность: Сохранение целостности при вибрациях и температурных расширениях пластин.
| Тип сепаратора | Материал | Ключевое преимущество |
|---|---|---|
| Мипор | Полиэтилен | Высокая пористость (>60%) |
| Стекловолокно | Кварцевые микроволокна | Устойчивость к глубоким разрядам |
| AGM | Стекломат | Капиллярный эффект для рекомбинации газов |
Современные сепараторы типа AGM дополнительно выполняют функцию удержания электролита за счет капиллярных сил. Это препятствует его расслоению, обеспечивает рекомбинацию кислорода в замкнутом цикле и позволяет эксплуатировать АКБ в любом пространственном положении без утечек.
Формирование ЭДС элемента (примерно 2 В)
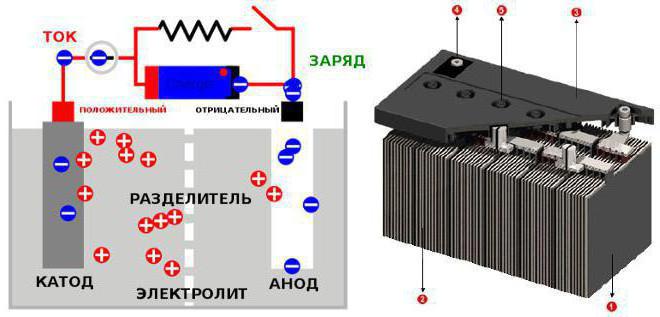
Электродвижущая сила свинцово-кислотного элемента формируется за счет разности электрохимических потенциалов между положительным (PbO₂) и отрицательным (Pb) электродами, погруженными в сернокислотный электролит (H₂SO₄). Каждый электрод имеет характерное равновесное значение потенциала относительно стандартного водородного электрода, обусловленное протекающими на них окислительно-восстановительными реакциями.
Суммарная ЭДС элемента рассчитывается как разность потенциалов полуреакций на катоде и аноде. Для стандартных условий (25°C, концентрация H₂SO₄ ~30-40%) потенциал восстановления диоксида свинца составляет ≈ +1.69 В, а потенциал окисления губчатого свинца ≈ -0.35 В. Комбинирование этих значений дает теоретическую ЭДС: 1.69 В − (-0.35 В) = 2.04 В, что округляется до типовых 2 В.
| Электрод | Химическая реакция | Потенциал (В) |
|---|---|---|
| Положительный (катод при разряде) | PbO₂ + SO₄²⁻ + 4H⁺ + 2e⁻ → PbSO₄ + 2H₂O | +1.69 |
| Отрицательный (анод при разряде) | Pb + SO₄²⁻ → PbSO₄ + 2e⁻ | -0.35 |
Фактическое значение ЭДС зависит от ключевых параметров:
- Концентрация электролита: Рост плотности H₂SO₄ увеличивает ЭДС (~2.14 В при 40% растворе)
- Температура: Снижение температуры уменьшает ЭДС
- Состояние заряда: При разряде ЭДС падает из-за накопления PbSO₄ и снижения концентрации кислоты
Измерение ЭДС без нагрузки (напряжение холостого хода) служит индикатором степени заряженности аккумулятора. Для исправного элемента диапазон составляет 2.0-2.2 В, при этом отклонение от номинала 2 В сигнализирует о необходимости обслуживания.
Внутреннее сопротивление и его влияние на отдачу тока
Внутреннее сопротивление (Rвн) кислотно-свинцового аккумулятора – комплексное свойство, объединяющее омическое сопротивление электродов, электролита, сепараторов и сопротивление поляризации при электрохимических реакциях. Оно препятствует свободному прохождению тока, вызывая падение напряжения на клеммах при нагрузке согласно закону Ома: ΔU = I * Rвн, где I – ток разряда.
Высокое Rвн ограничивает пиковую отдачу тока и эффективную ёмкость аккумулятора. При резком увеличении нагрузки (например, стартерный запуск) напряжение под нагрузкой (Uнагр) падает по формуле: Uнагр = ЭДС - I * Rвн. Если Uнагр опускается ниже порога работоспособности оборудования, аккумулятор не может обеспечить требуемую мощность.
Ключевые факторы влияния Rвн
Основные последствия роста внутреннего сопротивления:
- Снижение напряжения под нагрузкой – приводит к преждевременному срабатыванию защиты электронных систем.
- Падение полезной мощности – часть энергии рассеивается в виде тепла (Pпотерь = I² * Rвн).
- Уменьшение доступной ёмкости – при высоких токах аккумулятор отдаёт меньше энергии из-за ускоренного падения напряжения.
- Перегрев элементов – джоулево тепло ускоряет коррозию решёток и деградацию активной массы.
Факторы, повышающие Rвн:
| Фактор | Механизм воздействия |
|---|---|
| Низкий заряд (SoC) | Уменьшение концентрации H2SO4 снижает проводимость электролита |
| Температура < 20°C | Рост вязкости электролита и замедление ионного переноса |
| Сульфатация пластин | Слой PbSO4 блокирует активную поверхность, увеличивая поляризацию |
| Деградация электродов | Коррозия решёток и осыпание активной массы нарушают контакты |
Мониторинг Rвн – ключевой метод диагностики старения аккумулятора. Прирост значения на 20-30% от номинала сигнализирует о необходимости замены.
Циклирование ресурса: разряд-заряд
При разряде аккумулятора происходит электрохимическая реакция между электродами и электролитом. Свинцовый диоксид (PbO₂) на положительной пластине и губчатый свинец (Pb) на отрицательной взаимодействуют с серной кислотой (H₂SO₄), образуя сульфат свинца (PbSO₄) и воду (H₂O). Высвобождаемые электроны создают ток во внешней цепи, напряжение на клеммах постепенно снижается до минимально допустимого уровня.
Во время заряда к аккумулятору прикладывается внешнее напряжение, превышающее его ЭДС. Ток протекает в обратном направлении, запуская обратные реакции: сульфат свинца на электродах разлагается, восстанавливая PbO₂ на аноде и Pb на катоде. Концентрация серной кислоты в электролите возрастает, повышая плотность раствора. Процесс сопровождается выделением кислорода и водорода при перезаряде.
Ключевые особенности циклирования
- Сульфатация: Накопление нерастворимого PbSO₄ при глубоком разряде или хранении в разряженном состоянии снижает ёмкость.
- Температурный режим: Перегрев (>45°C) ускоряет коррозию решёток, а холод (<0°C) замедляет реакции и повышает вязкость электролита.
- Глубина разряда (DoD): Глубокие разряды (80-100% DoD) сокращают ресурс в 3-5 раз по сравнению с умеренными (20-30% DoD).
| Параметр | Разряд | Заряд |
|---|---|---|
| Химические реакции | PbO₂ + Pb + 2H₂SO₄ → 2PbSO₄ + 2H₂O | 2PbSO₄ + 2H₂O → PbO₂ + Pb + 2H₂SO₄ |
| Плотность электролита | Снижается (1.28→1.10 г/см³) | Повышается (1.10→1.28 г/см³) |
| Напряжение на элемент | 2.1В → 1.75В | 2.3В → 2.7В (буферный режим) |
Ресурс цикла определяется качеством материалов, конструкцией пластин и соблюдением режимов. Превышение зарядного напряжения или тока вызывает терморазгон и выкипание электролита, а хронический недозаряд ведёт к расслоению кислоты и необратимой сульфатации. Оптимальная зарядка включает стадии основного заряда (постоянным током) и дозаряда (постоянным напряжением).
Различия в работе стартерных и тяговых аккумуляторов
Стартерные свинцово-кислотные аккумуляторы предназначены для кратковременных мощных разрядов, необходимых при запуске двигателя внутреннего сгорания. Они отдают ток в сотни ампер за 1-5 секунд, после чего быстро восстанавливают заряд от генератора. Конструкция использует большое количество тонких свинцовых пластин с пористой структурой для максимальной площади контакта с электролитом.
Тяговые аккумуляторы рассчитаны на длительное обеспечение энергией электродвигателей (погрузчики, лодки, инвалидные коляски). Они работают в циклическом режиме: медленный глубокий разряд (до 80% ёмкости) в течение нескольких часов с последующей полной зарядкой. Применяются пластины увеличенной толщины с плотным активным веществом для устойчивости к глубоким разрядам.
Ключевые отличия в эксплуатации
| Параметр | Стартерный | Тяговый |
| Тип разряда | Кратковременный (секунды), высокий ток | Длительный (часы), стабильный ток |
| Глубина разряда | Поверхностный (10-20%) | Глубокий (50-80%) |
| Конструкция пластин | Тонкие, пористые, большое количество | Толстые, плотные, меньшее количество |
| Режим работы | Буферный (постоянный заряд) | Циклический (разряд-заряд) |
Критическое различие: использование стартерного аккумулятора в тяговом режиме вызывает сульфатацию и осыпание пластин из-за глубоких разрядов. Тяговые модели теряют пусковую мощность при −20°С из-за меньшей площади контакта с электролитом.
Обслуживание тяговых АКБ включает регулярную полную зарядку для предотвращения расслоения электролита, тогда как стартерные требуют контроля уровня электролита и напряжения на клеммах.
Особенности герметизированных необслуживаемых (SLA/VRLA) батарей
Герметизированные свинцово-кислотные аккумуляторы (VRLA) исключают долив воды благодаря рекомбинации газов внутри корпуса. Конструктивно они делятся на два типа: с абсорбированным электролитом в стекломате (AGM) и с гелеобразным электролитом (GEL). Оба варианта содержат предохранительный клапан, сбрасывающий избыточное давление при критических условиях.
Кислородный цикл обеспечивает необслуживаемость: кислород, выделяемый на положительном электроде при заряде, диффундирует к отрицательному электроду. Там он реагирует со свинцом, восстанавливая воду. Это подавляет потерю электролита и позволяет использовать батарею в любом пространственном положении без утечек.
Ключевые характеристики
- Герметичность: Корпус полностью запаян, электролит иммобилизован (в AGM – пропитанный сепаратор, в GEL – силикатный гель).
- Клапанная регулировка: Предохранительный клапан открывается только при превышении давления > 5-30 кПа, предотвращая взрыв.
- Саморазряд: Уменьшен до 1-3% в месяц благодаря чистоте материалов и герметизации.
| Тип | AGM | GEL |
|---|---|---|
| Импеданс | Низкий | Высокий |
| Ток заряда | Допускает быструю зарядку | Требует медленного заряда |
| Вибрационная стойкость | Высокая | Средняя |
Ограничения эксплуатации: Чувствительны к перезаряду – превышение напряжения > 14.4 В вызывает необратимую потерю воды через клапан. Требуют температурной компенсации заряда (-3 мВ/°С на элемент). При глубоких разрядах (< 80%) резко сокращается ресурс.
Сферы применения: ИБП, телекоммуникационное оборудование, системы безопасности, медицинские приборы, электромобили (вспомогательные системы), солнечные электростанции. Не используются в стартерных системах из-за ограничений по пиковому току.
Контроль напряжения зарядки для предотвращения сульфатации
Сульфатация пластин возникает при длительном нахождении аккумулятора в частично или полностью разряженном состоянии, когда на электродах образуются крупные кристаллы сульфата свинца (PbSO4). Этот процесс снижает ёмкость батареи и сокращает срок её службы.
Контроль напряжения при зарядке критичен, так как недозаряд усиливает сульфатацию, а перезаряд вызывает коррозию решёток и потерю воды. Оптимальные параметры зарядки зависят от температуры и типа аккумулятора.
Ключевые принципы контроля
Цикличная зарядка: Трёхступенчатый режим (основной заряд → абсорбция → плавающее напряжение) предотвращает сульфатацию:
- Основная зарядка: ток постоянен до достижения 14.4–14.8 В
- Абсорбция: напряжение стабилизируется (2–3 часа) для полного преобразования PbSO4
- Плавающий режим: поддержание 13.2–13.8 В для компенсации саморазряда
Температурная компенсация: Зарядное напряжение корректируется на ±3 мВ/°С на элемент при отклонениях от +25°C. Примеры регулировок:
| Температура (°C) | Напряжение (В) |
|---|---|
| 0 | 14.8–15.0 |
| 25 | 14.4–14.6 |
| 40 | 13.9–14.1 |
Регулярная выравнивающая зарядка: Кратковременная подача повышенного напряжения (15.5–16.2 В) раз в 1–2 месяца разрушает начальные кристаллы сульфатов. Требует контроля уровня электролита.
Тепловой разгон: причины возникновения в VRLA батареях

Тепловой разгон представляет собой критическое неконтролируемое повышение температуры внутри VRLA аккумулятора, вызванное положительной обратной связью между температурой и током. Повышение температуры ускоряет электрохимические реакции и снижает внутреннее сопротивление, что ведет к дальнейшему росту тока и выделению тепла. Этот лавинообразный процесс может привести к разрушению корпуса, возгоранию или взрыву батареи.
Основная опасность теплового разгона заключается в его самоускоряющемся характере: после запуска процесса остановить его внешними средствами практически невозможно. В герметичных VRLA батареях риски усугубляются ограниченным отводом тепла и газов, а также рекомбинационным циклом, который сам по себе является экзотермической реакцией.
Ключевые причины теплового разгона
Основными факторами, провоцирующими тепловой разгон, являются:
- Перезаряд: Превышение напряжения заряда вызывает интенсивный электролиз воды с выделением тепла и кислорода. Кислород, реагируя с отрицательным электродом в процессе рекомбинации, дополнительно нагревает элемент.
- Высокая температура окружающей среды: Эксплуатация или заряд в условиях повышенных температур (выше +40°C) снижает порог срабатывания теплового разгона из-за изначально высокого теплового фона.
- Внутренние дефекты:
- Короткие замыкания между пластинами через сепаратор
- Сильная сульфатация или коррозия решеток
- Расслоение электролита (в AGM-батареях)
- Потеря воды и высыхание сепаратора
- Неисправность системы охлаждения/вентиляции: Недостаточный отвод тепла от батарейного отсека или блокировка вентиляционных каналов корпуса VRLA.
- Несовместимое зарядное устройство: Использование ЗУ с некорректными параметрами (завышенное напряжение, отсутствие температурной компенсации) или предназначенного для батарей других типов.
- Неравномерность элементов в банке: Разбаланс по емкости или внутреннему сопротивлению между отдельными ячейками приводит к перезаряду слабых элементов и локальному перегреву.
Список источников
Для подготовки статьи о принципах работы кислотно-свинцовых аккумуляторов использовались авторитетные научные и технические материалы. Основное внимание уделялось фундаментальным физико-химическим процессам и современным исследованиям в области электрохимических источников тока.
Ниже представлен перечень ключевых литературных источников, содержащих детальное описание устройства, электрохимических реакций и эксплуатационных характеристик свинцово-кислотных аккумуляторов. Все материалы доступны в печатных изданиях или электронных библиотеках технических вузов.
Научные и технические публикации
- Пасынков В.В. "Источники электропитания электронных средств" - Глава 4: Химические источники тока
- Данилов А.М., Смирнов В.М. "Электрохимические источники энергии" - Раздел: Свинцовые аккумуляторы
- ГОСТ Р МЭК 60896-11-2016 "Стационарные свинцово-кислотные аккумуляторы" - Общие требования и методы испытаний
- Bagshaw N. "Lead-Acid Battery Chemistry" в издании "Encyclopedia of Electrochemical Power Sources"
- Pavlov D. "Lead-Acid Batteries: Science and Technology" - Глава 2: Основы электрохимических процессов
- Учебное пособие "Химические источники тока" под ред. Коровин Н.В. - Раздел 3.1: Свинцовые аккумуляторы
- Журнал "Электрохимическая энергетика" №4(2021) - Статья Иванов С.К. "Современные модификации свинцовых аккумуляторов"
