Этилен против метана - секрет более яркого пламени
Статья обновлена: 01.03.2026
Этилен и метан – углеводороды с фундаментальными различиями в строении молекул, определяющими их химическое поведение. При горении этилен выделяет яркое светящееся пламя, контрастирующее с голубоватым малозаметным пламенем метана. Этот визуальный эффект напрямую связан с уникальными особенностями молекулы C2H4.
Ключевая причина различий кроется в повышенном содержании углерода в этилене (85.7% против 75% в метане) и его ненасыщенной природе. Двойная связь между атомами углерода в этилене создаёт условия для неполного окисления и образования микрочастиц сажи в пламени.
Эти раскалённые углеродные частицы излучают интенсивный жёлтый свет – явление теплового излучения, отсутствующее при сгорании метана, где преобладает полное окисление до CO2 и H2O.
Электронное строение двойной связи в молекуле этилена

Молекула этилена (C2H4) содержит двойную связь между атомами углерода, образованную σ-связью и π-связью. σ-Связь возникает при осевом перекрывании sp2-гибридных орбиталей углерода, обеспечивая прочное соединение атомов. Гибридизация sp2 формирует плоскую геометрию молекулы с углом 120°.
π-Связь образуется за счет бокового перекрывания негибридизированных 2pz-орбиталей углерода, расположенных перпендикулярно плоскости молекулы. Электронное облако π-связи сосредоточено выше и ниже плоскости атомов, обладает меньшей плотностью и повышенной реакционной способностью по сравнению с σ-связью.
Ключевые особенности двойной связи
- Энергия связи: 611 кДж/моль (значительно выше, чем у одинарной связи в этане – 368 кДж/моль).
- Длина связи: 0.134 нм (короче, чем C–C в метане – 0.154 нм).
- π-Электроны делокализованы и легко поляризуются.
| Тип связи | Механизм образования | Энергия (кДж/моль) |
| σ-Связь (C=C) | Перекрывание sp2-орбиталей | ~345 |
| π-Связь (C=C) | Перекрывание 2pz-орбиталей | ~266 |
Повышенное содержание углерода (85.7% масс.) и наличие подвижных π-электронов в этилене способствуют неполному окислению при горении. В отличие от метана (75% углерода), это приводит к образованию микрочастиц сажи, раскаляющихся в пламени и излучающих интенсивный желто-белый свет.
Процентное содержание углерода в этилене и метане
Ключевым фактором, определяющим характер горения углеводородов, в частности, яркость пламени, является процентное содержание углерода в их молекулах. Более высокое содержание углерода способствует образованию большего количества раскаленных частиц сажи в пламени, которые и излучают интенсивный свет. Сравнительный анализ метана и этилена подтверждает эту закономерность.
Массовая доля углерода рассчитывается как отношение массы углерода в молекуле к общей массе молекулы, выраженное в процентах. Для метана (CH₄) атомная масса углерода (C) равна 12, водорода (H) - 1. Масса молекулы: 12 + (4 * 1) = 16 г/моль. Масса углерода: 12 г/моль. Процентное содержание углерода: (12 / 16) * 100% = 75%.
Сравнение процентного содержания углерода
Расчет для этилена (C₂H₄) показывает существенно более высокое значение:
- Молекулярная масса: (2 * 12) + (4 * 1) = 24 + 4 = 28 г/моль
- Масса углерода: 2 * 12 = 24 г/моль
- Процентное содержание углерода: (24 / 28) * 100% ≈ 85.7%
Таким образом, массовая доля углерода в этилене (примерно 85.7%) значительно выше, чем в метане (75%). Это различие является основной причиной более светящегося пламени этилена.
| Параметр | Метан (CH₄) | Этилен (C₂H₄) |
|---|---|---|
| Молекулярная формула | CH₄ | C₂H₄ |
| Молекулярная масса (г/моль) | 16 | 28 |
| Масса углерода в молекуле (г/моль) | 12 | 24 |
| Массовая доля углерода (%) | 75.0 | ≈85.7 |
Разница в содержании углерода (~10.7%) приводит к тому, что при горении этилена образуется значительно больше несгоревших микрочастиц углерода (сажи), которые нагреваются в восстановительной зоне пламени до высокой температуры и излучают видимый свет. В случае метана сгорание протекает полнее, с образованием преимущественно углекислого газа и воды, и светимость пламени гораздо ниже.
Зависимость яркости пламени от углеродного скелета
Яркость пламени углеводородов определяется количеством раскалённых частиц углерода (сажи), образующихся при неполном окислении. Чем выше доля углерода в молекуле и сложнее её структура, тем интенсивнее выделение сажи. Насыщенные углеводороды (алканы) склонны к полному сгоранию до CO₂ и H₂O, тогда как ненасыщенные (алкены, алкины) из-за повышенного содержания углерода и прочных π-связей чаще образуют микрочастицы сажи при горении.
Метан (CH₄), как простейший алкан, содержит лишь 75% углерода по массе и горит почти без образования сажи, давая бледно-голубое пламя. Этилен (C₂H₄) при равной массе содержит уже 86% углерода, а его двойная связь затрудняет полное окисление. В пламени молекулы этилена распадаются с образованием кластеров углерода, которые нагреваются до свечения, обеспечивая яркое жёлтое излучение.
Ключевые факторы влияния углеродного скелета
- Отношение C:H – рост доли углерода повышает сажеобразование (метан: 1:4, этилен: 1:2).
- Насыщенность связей – двойные/тройные связи замедляют окисление, способствуя формированию сажи.
- Длина цепи – увеличение числа атомов углерода усиливает свечение (этин > этилен > этан).
Механизм образования сажи при горении углеводородов
Образование сажи начинается с термического разложения (пиролиза) углеводородов при высоких температурах. Ненасыщенные соединения, такие как этилен (C2H4), легче подвергаются пиролизу из-за наличия двойной связи, которая разрывается с образованием реакционноспособных радикалов (например, винила C2H3∙) и ацетилена (C2H2). Эти фрагменты служат строительными блоками для синтеза ароматических структур.
Последующая конденсация ароматических колец приводит к росту полициклических ароматических углеводородов (ПАУ). Ключевые стадии включают:
- Циклизацию алифатических цепей в бензольные ядра
- Последовательное присоединение ацетилена и радикалов к краям ПАУ
- Коагуляцию кластеров углерода с формированием наночастиц сажи (>2 нм)
Ненасыщенные углеводороды образуют сажу интенсивнее, чем насыщенные (например, метан), по двум причинам:
- Их молекулы прямо участвуют в образовании ароматических колец без стадии крекинга
- Они генерируют больше ацетилена – ключевого "строительного материала" для ПАУ
| Фактор | Метан (CH4) | Этилен (C2H4) |
|---|---|---|
| Стабильность молекулы | Высокая (требует >1200°C) | Низкая (разлагается при >700°C) |
| Выход ацетилена | Менее 10% | До 50% |
| Скорость роста ПАУ | Медленная | Экспоненциальная |
Свечение пламени возникает при нагреве сажевых частиц до 1200-1800°C. Поскольку этилен генерирует на порядок больше сажи, чем метан, его пламя излучает более интенсивный желтый свет за счет теплового свечения углеродных кластеров.
Ключевая роль неполного сгорания в свечении пламени
Свечение пламени углеводородов, особенно хорошо заметное у этилена, напрямую связано с процессом неполного сгорания топлива. При идеальном (полном) сгорании углеводородов образуются только углекислый газ (CO₂) и вода (H₂O), а пламя имеет голубоватый цвет и излучает мало видимого света. Однако на практике, особенно в диффузионных пламенях (где топливо и окислитель смешиваются в зоне горения), условия для полного окисления часто не достигаются.
Неполное сгорание приводит к образованию промежуточных продуктов, среди которых наиболее важную роль в излучении света играют твердые частицы углерода – сажа. Эти микроскопические частицы раскаляются в высокотемпературной зоне пламени до температур, при которых они интенсивно излучают свет в видимом диапазоне спектра, преимущественно желтый и оранжевый. Чем больше сажи образуется и чем выше температура ее нагрева, тем ярче и светлее кажется пламя.
Почему этилен производит больше сажи?
Этилен (C₂H₄) горит более светящимся пламенем, чем метан (CH₄), именно из-за его большей склонности к образованию сажи при горении. Эта разница обусловлена структурой молекул:
- Высокое содержание углерода: Этилен имеет более высокую массовую долю углерода (85,7%) по сравнению с метаном (75%). Это означает, что на единицу массы топлива в реакцию вступает больше атомов углерода, которые потенциально могут превратиться в сажу при недостатке кислорода.
- Ненасыщенность (двойная связь): Наличие двойной связи C=C делает молекулу этилена более реакционноспособной и склонной к реакциям полимеризации и конденсации. В пламени фрагменты этиленовых молекул (радикалы) легко объединяются, образуя более крупные ароматические структуры (например, бензол), которые являются предшественниками сажевых частиц.
- Механизм образования сажи: Процесс начинается с пиролиза (термического разложения) углеводорода. Радикалы, образующиеся из этилена, гораздо быстрее и эффективнее участвуют в реакциях роста углеродных цепей и колец, ведущих к формированию стабильных кластеров сажи.
Метан же, будучи насыщенным углеводородом с простыми связями C-H и более низким содержанием углерода, горит преимущественно через путь полного окисления до CO₂. Его молекула устойчивее к пиролизу и реакциям конденсации. Даже при неполном сгорании метан образует в основном оксид углерода (CO) и водород (H₂), а не сажу, поэтому его пламя светится слабо.
| Характеристика | Метан (CH₄) | Этилен (C₂H₄) |
|---|---|---|
| Тип углеводорода | Насыщенный (алкан) | Ненасыщенный (алкен, двойная связь) |
| Массовая доля углерода, % | 75.0 | 85.7 |
| Склонность к пиролизу и коксованию | Низкая | Высокая |
| Основные продукты неполного сгорания | CO, H₂ | Сажа, полиароматические углеводороды |
| Светимость пламени | Слабая (голубоватое) | Сильная (ярко-желтое, светящееся) |
Таким образом, яркое свечение пламени этилена является прямым следствием его молекулярной структуры, которая предрасполагает к интенсивному образованию раскаленных частиц сажи в процессе неполного сгорания, в отличие от метана, сгорающего более полно с минимальным сажеобразованием.
Температурные различия горения этилена и метана
Горение этилена характеризуется более высокой температурой пламени по сравнению с метаном. Это обусловлено различиями в молекулярной структуре: этилен (C₂H₄) содержит двойную связь между атомами углерода, что повышает его реакционную способность. При распаде молекулы в пламени высвобождается больше энергии на единицу массы.
Метан (CH₄), как простейший алкан, образует менее энергичное пламя из-за стабильных одинарных связей C-H. Эффективность окисления этилена выше, так как его молекулы легче распадаются на реакционноспособные фрагменты (например, радикалы ·CH₂), что ускоряет цепные реакции и увеличивает тепловыделение.
Ключевые факторы температурной разницы
- Энергия связей: Двойная связь C=C в этилене (607 кДж/моль) слабее связей C-H в метане (413 кДж/моль), что облегчает инициирование реакции.
- Скорость окисления: Этилен быстрее реагирует с кислородом, образуя промежуточные соединения (формальдегид, СО), чье последующее сгорание резко повышает температуру.
- Теплота сгорания: Удельная теплота сгорания этилена (~50.3 МДж/кг) превышает показатель метана (~50.0 МДж/кг) при полном окислении до CO₂ и H₂O.
Сравнение параметров горения:
| Параметр | Этилен | Метан |
| Макс. температура пламени (°C) | ~2,200 | ~1,960 |
| Скорость горения (см/с) | 0.68 | 0.38 |
| Содержание углерода (%) | 85.7 | 75.0 |
Примечание: Более высокая доля углерода в этилене способствует образованию раскалённых частиц сажи, что усиливает свечение пламени. В метане преобладает голубое излучение от возбуждённых газообразных продуктов (CH*, CO₂*), тогда как в этиленовом пламени доминирует жёлтое тепловое излучение твёрдых частиц.
Скорость диффузии кислорода при сжигании газов
Диффузия кислорода определяет интенсивность его поступления в зону горения. Чем выше скорость диффузии, тем эффективнее окисление топлива и полнее сгорание. Этот параметр напрямую влияет на температуру пламени и образование промежуточных продуктов пиролиза.
При сжигании этилена диффузия кислорода происходит медленнее, чем для метана. Это обусловлено более высокой молекулярной массой этилена (28 г/моль против 16 г/моль у метана) и сложной структурой его молекулы. Сниженная скорость поступления окислителя создает условия для неполного сгорания.
Ключевые закономерности
- Закон Грэма: скорость диффузии газа обратно пропорциональна квадратному корню из его молярной массы: v1/v2 = √(M2/M1)
- Влияние на горение: замедленная диффузия кислорода к молекулам этилена способствует дегидрированию и образованию свободного углерода
- Термодинамика: локальный дефицит O2 повышает температуру в восстановительной зоне пламени до 1200-1400°C
| Параметр | Метан (CH4) | Этилен (C2H4) |
|---|---|---|
| Относительная скорость диффузии O2 | 1.32 (высокая) | 1.0 (базовая) |
| Режим горения | Полное окисление | Частичное пиролизное разложение |
| Визуальный эффект | Голубое прозрачное пламя | Желтое светящееся пламя |
Образующиеся при дефиците кислорода углеродные частицы раскаляются и излучают видимый свет. Этим объясняется повышенная светимость пламени этилена по сравнению с метаном, где быстрое смешение с O2 обеспечивает полное сгорание без сажеобразования.
Энергия диссоциации связей C-H и C=C
Энергия диссоциации связи C-H в этилене (464 кДж/моль) выше, чем в метане (439 кДж/моль), что обусловлено sp²-гибридизацией углерода и повышенной электронной плотностью в молекуле. Несмотря на это, общая стабильность этилена ниже из-за наличия реакционноспособной π-связи в группе C=C.
Двойная связь C=C в этилене имеет энергию диссоциации ~610 кДж/моль, что существенно ниже суммарной энергии четырёх связей C-H в метане. Эта особенность облегчает термический распад этилена при горении, способствуя образованию свободных радикалов и ненасыщенных фрагментов.
Факторы образования сажи
Ключевой причиной яркого свечения является пиролиз этилена с последующим образованием углеродных частиц:
- Низкое соотношение H/C (2:1 против 4:1 у метана) ограничивает полное окисление
- Двойная связь C=C служит "затравкой" для реакций циклизации
- Образованные полиароматические углеводороды (ПАУ) конденсируются в сажу
| Параметр | Метан | Этилен |
|---|---|---|
| Энергия C-H (кДж/моль) | 439 | 464 |
| Энергия C-C/C=C (кДж/моль) | 347 (C-C) | 610 (C=C) |
| Соотношение H/C | 4:1 | 2:1 |
| Температура начала пиролиза (°C) | >1200 | 800-900 |
Нагретые частицы сажи излучают жёлтый свет по механизму теплового свечения, тогда как метан окисляется преимущественно до CO₂ и H₂O без промежуточного образования углеродного остатка.
Поведение радикалов в этиленовом пламени

В этиленовом пламени ключевую роль играют радикалы, образующиеся при распаде C2H4 под действием высокой температуры. Двойная связь в этилене облегчает образование винилового радикала (C2H3∙), который инициирует каскад реакций. Ненасыщенная структура способствует быстрому накоплению ацетилена (C2H2) и пропаргила (H2CCCH∙), выступающих строительными блоками для ароматических соединений.
Радикальные реакции в зоне пиролиза этилена протекают с высокой скоростью из-за повышенной реакционной способности ненасыщенных промежуточных продуктов. Активные частицы (CH3∙, H∙, OH∙) атакуют молекулы этилена, генерируя новые радикалы и усиливая разветвление цепей. Это создаёт условия для интенсивного синтеза полициклических ароматических углеводородов (ПАУ) – предшественников сажи.
Механизм радикально-цепных процессов
Основные стадии сажеобразования включают:
- Инициирование: C2H4 + M → C2H3∙ + H∙ + M
- Образование ацетилена: C2H3∙ → C2H2 + H∙
- Синтез бензола:
- C2H3∙ + C4H4 → C6H6 + H∙
- n-C4H3∙ + C2H2 → C6H5∙
- Рост ПАУ: Последовательное присоединение C2H2 к радикалам аренов.
| Радикал | Роль в этиленовом пламени | Влияние на свечение |
|---|---|---|
| C2H3∙ | Основной инициатор цепей | Ускоряет синтез сажевых предшественников |
| H∙ | Участник реакций отрыва водорода | Повышает концентрацию C2H2 |
| C6H5∙ | Зародыш для роста ПАУ | Прямой предшественник сажи |
Высокая концентрация ненасыщенных радикалов в этиленовом пламени обеспечивает ускоренный рост углеродного скелета. При пиролизе метана (CH4) преобладают насыщенные радикалы (CH3∙), которые легче окисляются до CO2, что снижает выход сажи. Термическая стабильность C2H2 и ПАУ в этиленовом пламени позволяет частицам сажи достигать температур 1200–1500°C, при которых возникает интенсивное тепловое излучение в видимой области спектра.
Механизм термического крекинга в зоне горения
В зоне горения этилена возникают экстремально высокие температуры (свыше 1000°C), инициирующие термический крекинг молекул. Происходит гомолитический разрыв C-C и C-H связей с образованием высокореакционных свободных радикалов: метильных (CH3•), этильных (C2H5•), водородных (H•) и ацетиленовых (C2H2). Эти промежуточные частицы обладают высокой энергией и нестабильностью.
Радикалы участвуют в цепных реакциях дегидрирования, димеризации и конденсации. Этилен (C2H4) особенно склонен к образованию ароматических структур (бензола) и полициклических соединений через стадии ацетилена и винилацетилена. Последующая циклизация и рост углеродного скелета приводят к нуклеации сажевых частиц.
Сравнение крекинга этилена и метана
| Параметр | Метан (CH4) | Этилен (C2H4) |
|---|---|---|
| Прочность связи | Высокая энергия связи C-H (435 кДж/моль) | Двойная связь C=C реакционноспособна (легче разрывается) |
| Ключевые радикалы | CH3•, CH2: (метилен) | C2H3•, C2H2, C4H4 |
| Склонность к сажеобразованию | Минимальная (стабильные продукты окисления - CO2, H2O) | Высокая (синтез бензола → полиароматические углеводороды → сажа) |
Роль сажи в излучении пламени: Углеродные частицы, образующиеся при крекинге этилена, нагреваются в пламени до 1200-1400°C и испускают интенсивное тепловое излучение в видимом спектре (желто-оранжевое свечение). Метан генерирует преимущественно голубое хемилюминесцентное свечение от возбуждённых газофазных продуктов (CH*, CO2*).
Этапы формирования сажи из этилена:
- Инициирование: C2H4 → 2CH2: или C2H4 + H• → C2H3• + H2
- Рост цепи: C2H3• → C2H2 + H•; C2H2 + C2H2 → C4H4
- Циклизация: C4H4 → бензол (C6H6)
- Конденсация: Полимеризация ароматических колец в сажевые кластеры.
Образование полициклических ароматических углеводородов

При горении этилена в условиях ограниченного доступа кислорода и высоких температур (свыше 1000°C), характерных для светящейся зоны пламени, молекулы этилена (C₂H₄) подвергаются сложным превращениям. На начальных стадиях происходит дегидрирование и сочетание молекул, приводящее к образованию более крупных ненасыщенных углеводородов и радикалов. Ключевым этапом является формирование первого ароматического кольца – бензола (C₆H₆), часто через промежуточные соединения вроде ацетилена (C₂H₂) и винилацетилена (C₄H₄).
Образовавшиеся молекулы бензола и другие одноядерные ароматические углеводороды служат "строительными блоками" для полициклических ароматических углеводородов (ПАУ). Они могут конденсироваться между собой или с активными ацетиленовыми радикалами (C₂H*, HC₂*) под действием тепла. Например, бензол, реагируя с винилацетиленом или подобными видами, образует нафталин. Последующий рост структуры происходит путем:
- Добавления ацетиленовых звеньев: Присоединение радикалов C₂H₂ или C₄H₄ к краю существующего ароматического ядра.
- Циклодегидрирования: Образование нового ароматического кольца за счет внутримолекулярных реакций дегидрирования в присоединенной алифатической цепи.
- Конденсации ПАУ: Объединение уже сформированных ПАУ между собой.
Этот каскад реакций последовательно наращивает систему сопряженных ароматических колец. По мере роста молекулярной массы и усложнения структуры ПАУ теряют атомы водорода, становясь все менее летучими. В конечном итоге, крупные ПАУ слипаются, формируя первые твердые углеродистые частицы – сажу, которая и является основным источником яркого желтого свечения пламени этилена.
Свечение сажевых частиц при высоких температурах
Горение этилена сопровождается интенсивным образованием сажи из-за его высокой склонности к пиролизу и термическому разложению. При температурах выше 500°C углеродные частицы раскаляются в пламени, излучая видимый свет преимущественно в жёлто-оранжевом спектре.
Свечение возникает вследствие теплового излучения наночастиц углерода, нагретых до 1000–1400°C. Эффективность свечения зависит от концентрации частиц, их размера и температуры пламени. Этилен генерирует больше сажи, чем метан, благодаря более высокому соотношению C/H (85,7% против 75%) и склонности к реакциям полимеризации.
Факторы, усиливающие свечение
Ключевые причины яркого свечения сажи в этиленовом пламени:
- Повышенное образование сажевых частиц из-за конденсации углерода при пиролизе: C2H4 → 2C + 2H2
- Большая площадь поверхности частиц (20–100 нм), обеспечивающая интенсивное тепловое излучение
- Неполное окисление углерода в восстановительной зоне пламени, продлевающее "жизнь" частиц
| Параметр | Этилен | Метан |
|---|---|---|
| Выход сажи (% масс.) | ~45% | ~5% |
| Температура пламени (°C) | до 1400 | до 1200 |
| Яркость свечения | Высокая | Низкая |
Метан горит голубым пламенем с минимальным свечением, так как почти полностью окисляется до CO2 и H2O без образования значительного количества сажи. Конкуренция между реакциями окисления и пиролиза в этиленовом пламени смещена в сторону образования углеродных кластеров.
Кинетика образования светящихся зон в пламени
Ключевым фактором повышенной светимости пламени этилена является интенсивное образование сажи в зоне пиролиза. Этилен (C₂H₄), благодаря наличию двойной связи, легко вступает в реакции циклизации и полимеризации при высоких температурах. Эти процессы приводят к быстрому формированию полициклических ароматических углеводородов (ПАУ) – основных предшественников сажевых частиц.
Кинетика сажеобразования в пламени этилена характеризуется ускоренными темпами по сравнению с метаном. Рост концентрации ацетилена (C₂H₂) и радикалов C₃H₃ в зоне реакции способствует реакциям конденсации и нуклеации. Последующее укрупнение частиц происходит через механизмы поверхностного роста (путем присоединения C₂H₂) и коагуляции, что увеличивает их размер и оптическую плотность.
Сравнительные кинетические особенности
Основные отличия в кинетике сажеобразования между этиленом и метаном:
- Скорость нуклеации: Этилен генерирует в 5-7 раз больше зародышей сажи на начальной стадии из-за реакций димеризации C₃H₃ → C₆H₆ (бензол).
- Роль ацетилена: В пламени этилена концентрация C₂H₂ достигает максимума быстрее, обеспечивая интенсивный поверхностный рост частиц (Csoot-H + C₂H₂ → Csoot-C₂H + H₂).
- Окисление частиц: Метан образует больше OH-радикалов, которые эффективно окисляют сажу на ранних стадиях, подавляя её накопление.
| Параметр | Этилен | Метан |
|---|---|---|
| Время образования ПАУ (мс) | 0.2-0.5 | 1.0-1.8 |
| Концентрация C₂H₂ на пике (% об.) | 8-12 | 3-5 |
| Выход сажи (г/кг топлива) | 25-40 | 0.1-0.5 |
Термическое излучение сажевых частиц при T>1300°C доминирует в видимом спектре, создавая желтое свечение. Более высокая плотность и размер частиц в пламени этилена увеличивают коэффициент поглощения излучения в 10-30 раз по сравнению с метаном, что объясняет разницу в светимости.
Сравнение коэффициента избытка воздуха для газов
Коэффициент избытка воздуха (α) является критическим параметром при сравнении горения различных углеводородных газов, таких как метан (CH₄) и этилен (C₂H₄). Он определяется как отношение фактического количества воздуха, поданного в зону горения, к стехиометрически необходимому количеству воздуха для полного сгорания топлива. Значение α = 1 соответствует теоретически идеальному соотношению топливо-воздух без избытка или недостатка окислителя.
Метан (CH₄) и этилен (C₂H₄) существенно различаются по своему стехиометрическому соотношению воздух/газ из-за разной атомарной структуры и соотношения C/H. Для полного сгорания метана требуется значительно больше воздуха в расчете на единицу объема газа, чем для этилена. Однако ключевое различие проявляется при горении с образованием светящегося пламени.
Основные отличия в требуемом избытке воздуха:
- Стехиометрическое соотношение (α=1): Для метана (CH₄ + 2O₂ → CO₂ + 2H₂O) стехиометрическая смесь составляет примерно 9.5-10 объемов воздуха на 1 объем газа. Для этилена (C₂H₄ + 3O₂ → 2CO₂ + 2H₂O) требуется около 14.5-15 объемов воздуха на 1 объем газа. Этилен изначально требует больше воздуха для полного сгорания в стехиометрических условиях из-за более высокого содержания углерода.
- Формирование светящегося пламени: Яркое, светящееся (коптящее) пламя возникает при неполном сгорании, когда в пламени присутствует недостаток кислорода для полного окисления всего углерода до CO₂. В этих условиях происходит пиролиз, образуются частицы сажи (углерода), которые раскаляются и излучают видимый свет.
- Коэффициент избытка воздуха для светящегося пламени: Чтобы получить устойчивое светящееся пламя, для этилена требуется значительно меньший коэффициент избытка воздуха (α < 1) по сравнению с метаном. Другими словами, горение этилена должно происходить при более выраженном недостатке воздуха, чем горение метана, для достижения сопоставимой яркости свечения.
Причина различия: Высокое содержание углерода в молекуле этилена (C₂H₄ - 85.7% по массе) по сравнению с метаном (CH₄ - 75% по массе) и его склонность к реакциям полимеризации и пиролиза при нагреве в условиях недостатка кислорода приводят к гораздо более интенсивному и легкому образованию сажи. Метану для образования заметного светящегося пламени также нужен недостаток воздуха (α < 1), но его "углеродный потенциал" для сажеобразования существенно ниже, чем у этилена.
| Параметр | Метан (CH₄) | Этилен (C₂H₄) |
|---|---|---|
| Химическая формула | CH₄ | C₂H₄ |
| Стехиометрическое соотношение (воздух : газ), ~об/об | 9.52 : 1 | 14.8 : 1 |
| Требуемый α для устойчивого светящегося пламени | ~0.7 - 0.9 (Заметный недостаток воздуха) | ~0.5 - 0.7 (Сильный недостаток воздуха) |
| Интенсивность свечения пламени (при сопоставимом α < 1) | Умеренная | Очень высокая |
Аэродинамика ламинарных пламен этилена и метана
Скорость ламинарного горения этилена (C₂H₄) в стехиометрической смеси с воздухом существенно превышает аналогичный показатель для метана (CH₄), достигая ~1,9 м/с против ~0,4 м/с при стандартных условиях. Эта разница обусловлена более высокой реакционной способностью этилена: двойная связь C=C и повышенное содержание углерода способствуют ускоренному протеканию цепных реакций окисления. В результате фронт пламени этилена тоньше и обладает большей кривизной, формируя более острый конус в горелочных установках.
Устойчивость ламинарного фронта этилена ниже из-за его склонности к турбулизации и самопроизвольному переходу в турбулентный режим даже при умеренных скоростях потока. Метан демонстрирует большую стабильность ламинарного течения благодаря меньшей скорости горения и более плавному градиенту температур. Различия в вязкости газов и коэффициентах диффузии радикалов (OH⁻, H⁺) дополнительно влияют на структуру потока: у этилена интенсивнее процессы тепломассопереноса в зоне предварительного подогрева.
Сравнительные характеристики пламени
Ключевые аэродинамические отличия проявляются в:
- Градиенте скорости: У этилена крутой сдвиг скоростей на границе пламя-газ усиливает конвективный перенос.
- Термодиффузионной устойчивости: Для метана характерно подавление пламеобразующих ячеек Ландау, тогда как этилен склонен к их формированию.
| Параметр | Этилен | Метан |
| Число Льюиса (Le) | ≈1.1 | ≈0.97 |
| Макс. кривизна фронта пламени | Высокая | Умеренная |
| Чувствительность к растяжению пламени | Выраженная | Слабая |
Повышенное сажеобразование в пламени этилена (светящаяся зона) изменяет локальную аэродинамику: частицы сажи увеличивают плотность потока, интенсифицируют радиационный теплообмен и способствуют формированию вторичных конвективных ячеек. В метановом пламени отсутствие сажи минимизирует эти эффекты, сохраняя ламинарный режим в более широком диапазоне расходов.
Термопарные измерения в разных зонах факела
Термопарные замеры в факелах метана и этилена выявляют существенные различия в температурных профилях. Для метана характерен более равномерный градиент с максимальной температурой (до 1950°C) в узкой зоне полного сгорания. Этилен демонстрирует резкий температурный скачок во внешней зоне диффузионного горения, где значения достигают 2100°C. Эта разница обусловлена динамикой протекания реакций пиролиза и окисления.
В факеле этилена термопары фиксируют выраженный температурный пик в области сажеобразования, где раскаленные углеродные частицы излучают видимый свет. Одновременно в приосевой зоне регистрируется снижение температуры на 150-200°C по сравнению с метановым пламенем из-за эндотермических процессов крекинга. Такое распределение напрямую коррелирует с визуальным наблюдением более яркого и светящегося пламени.
Ключевые температурные характеристики
| Зона факела | Метан, °C | Этилен, °C |
|---|---|---|
| Ядро (предпламенная зона) | 600-800 | 500-700 |
| Зона первичного горения | 1650-1750 | 1550-1650 |
| Область сажеобразования | Не выражена | 1950-2100 |
Интерпретация результатов:
- Снижение температуры в приосевой зоне этилена подтверждает затраты энергии на реакции крекинга с образованием сажи
- Пиковые значения в зоне дожигания объясняют светимость: раскаленные углеродные частицы (сажа) излучают в видимом спектре
- Более высокая интегральная температура этиленового пламени обеспечивает интенсивное тепловое излучение
Лабораторный эксперимент по визуализации пламени
Для наглядного сравнения характера горения метана и этилена соберите установку, состоящую из двух газоотводных трубок, подключенных к источникам соответствующих газов (баллонам или генераторам), и системы поджига. Надежно закрепите трубки в штативах на жаропрочных подставках, обеспечив расстояние между ними не менее 30 см для предотвращения взаимного влияния пламени. Убедитесь в герметичности соединений и наличии тяги в вытяжном шкафу.
Медленно откройте подачу метана на первой трубке, подожгите выходящий газ спичкой или горелкой Бунзена. Зафиксируйте параметры пламени: высоту, форму, цвет, степень свечения (свечение фона в затемненной лаборатории помогает оценить яркость). Повторите процедуру для этилена на второй трубке, соблюдая идентичные условия подачи газа (давление, расход). Визуально сравните оба пламени одновременно, обратив особое внимание на интенсивность желтого свечения и количество образуемой сажи.
Наблюдаемые различия и их причины
Ключевые визуальные отличия:
- Метан (CH4): Пламя голубоватое или синеватое у основания с бледно-желтым кончиком. Относительно прозрачное, малосветящееся.
- Этилен (C2H4): Пламя ярко-желтое по всей высоте, значительно более светящееся, часто с коптящим кончиком и заметным выделением черной сажи.
Причина усиленного свечения этилена: Более высокое отношение углерода к водороду в молекуле этилена (C:H = 1:2) по сравнению с метаном (C:H = 1:4). При горении этилена в условиях ограниченного доступа кислорода (внутри конуса пламени) происходит неполное окисление углерода. Образуются микрочастицы раскаленного сажистого углерода, которые, нагреваясь до высоких температур, испускают интенсивный желтый свет (явление теплового излучения). Метан, содержащий меньше углерода и больше водорода, сгорает полнее, образуя меньше сажи, и основное излучение приходится на синюю область спектра от возбужденных радикалов (например, CH*).
Пирометрический анализ цвета и яркости
Яркость и цвет пламени напрямую коррелируют с температурой горения и наличием твердых частиц. Этилен (C₂H₄) содержит более высокий процент углерода (85,7%) по сравнению с метаном (CH₄, 75%). При сгорании этилена образуется значительное количество микрочастиц сажи из-за неполного окисления углерода в богатой топливом зоне пламени.
Нагретые до высоких температур частицы сажи излучают интенсивный видимый свет по механизму теплового излучения (излучение абсолютно черного тела). Это явление усиливается цепным механизмом пиролиза этилена, генерирующим дополнительные углеродные структуры. Метан же сгорает почти полностью с минимальным образованием сажи, поэтому его пламя излучает преимущественно в сине-фиолетовом диапазоне за счет возбуждения молекул CH* и C₂*.
Ключевые факторы светимости
Пирометрический анализ позволяет количественно оценить параметры пламени через три основных аспекта:
- Температурный вклад: Максимум излучения сажи соответствует ~1200-1400°C (видимое свечение), тогда как газофазное излучение метана имеет пик при >1500°C (УФ-диапазон).
- Спектральное распределение: Пламя этилена демонстрирует непрерывный спектр из-за сажи, метана – дискретные полосы.
- Эффективность излучения: Сажа преобразует ~30% тепла в свет, молекулярные переходы – менее 5%.
| Параметр | Этилен | Метан |
| Цвет пламени | Желто-оранжевый | Голубой |
| Индекс свечения | Высокий (>100) | Низкий (<20) |
| Доминирующий механизм | Тепловое излучение сажи | Хемилюминесценция |
Измерения пирометров фиксируют повышенную яркость этиленового пламени благодаря его способности генерировать высокотемпературные углеродные частицы с оптически плотной структурой. Это подтверждается корреляцией между светимостью и концентрацией сажи, определяемой через коэффициент ослабления излучения.
Фотосъёмка спектра пламени в УФ-диапазоне
Фотосъёмка в ультрафиолетовом диапазоне позволяет визуализировать участки пламени, невидимые глазу, особенно зоны интенсивного образования активных промежуточных частиц. Для углеводородов характерно УФ-излучение от возбуждённых радикалов (C2, CH, OH), формирующихся в ходе реакций пиролиза и окисления. Регистрация этого излучения требует специальных УФ-чувствительных камер или конвертеров, а также оптических фильтров, отсекающих видимый свет.
При сравнении этилена и метана УФ-фотосъёмка выявляет ключевые различия в структуре пламени. Этилен генерирует значительно более интенсивное излучение в диапазоне 300-400 нм из-за повышенного содержания радикала C2 (диуглерода), образующего характерные полосы Свана. Метан, сгорая с меньшим образованием сажи и промежуточных углеродных структур, демонстрирует существенно слабее свечение в этой области, преобладающее излучение связано в основном с радикалом OH.
Анализ данных УФ-фотосъёмки
Результаты съёмки интерпретируются для определения:
- Пространственного распределения радикалов: Зоны максимальной концентрации C2 в пламени этилена.
- Температурных полей: По относительной интенсивности полос Свана.
- Кинетики реакций: Скоростей формирования и рекомбинации промежуточных частиц.
| Характеристика | Этилен | Метан |
|---|---|---|
| Интенсивность УФ-свечения (C2) | Высокая (синие/фиолетовые полосы) | Очень слабая |
| Основные излучающие радикалы | C2, CH, OH | OH, слабо CH |
| Причина различий | Высокое содержание углерода и склонность к сажеобразованию у этилена | |
Таким образом, УФ-спектрофотосъёмка непосредственно подтверждает связь между химическим составом топлива, механизмом горения и оптическими свойствами пламени. Интенсивное свечение этилена в УФ-диапазоне служит прямым указанием на его более сложную пиролитическую стадию с обильным образованием светящихся углеродных частиц и радикалов.
Анализ сажеобразования по шкале Баха
Шкала Баха количественно оценивает склонность углеводородов к образованию сажи при горении, основываясь на экспериментальных измерениях светимости пламени и концентрации твердых частиц. Чем выше значение по шкале, тем интенсивнее процесс сажеобразования, что напрямую коррелирует с яркостью свечения. Для этилена данный показатель существенно превышает значения, характерные для алканов, включая метан, что объясняется фундаментальными различиями в химической структуре и механизмах пиролиза.
Ключевым фактором является ненасыщенность этилена: наличие двойной связи C=C облегчает реакции полимеризации и циклизации, ведущие к формированию полиароматических углеводородов (ПАУ) – основных предшественников сажи. Метан же, как предельный углеводород, демонстрирует минимальные значения по шкале Баха из-за отсутствия механизмов быстрого образования углеродных кластеров. Его горение протекает преимущественно через полное окисление до CO₂ и H₂O без промежуточных стадий генерации сажи.
Сравнительные характеристики
- Этилен: Высокое значение по шкале Баха (∼4.5 усл. ед.) из-за:
- Легкости образования ацетилена (C₂H₂) как промежуточного продукта
- Склонности к реакциям димеризации и конденсации
- Формирования бензольных колец уже при 500-600°C
- Метан: Низкое значение по шкале Баха (∼0.1 усл. ед.) благодаря:
- Отсутствию прямых путей образования ПАУ
- Стабильности молекулы, требующей высоких температур для пиролиза
- Доминированию реакций полного окисления
Размер наночастиц сажи в этиленовом пламени
Образование сажи в этиленовом пламени происходит интенсивнее из-за его ненасыщенной химической структуры (C₂H₄), содержащей двойную углерод-углеродную связь. Эта особенность способствует реакциям полимеризации и циклизации промежуточных соединений, приводя к обильному формированию ароматических структур – предшественников сажи. Высокое содержание углерода в молекуле этилена (86% против 75% в метане) обеспечивает больший выход углеродных частиц при неполном сгорании.
Наночастицы сажи в этиленовом пламени имеют преимущественно меньший размер (10–30 нм) по сравнению с метановым (50–100 нм). Ключевым фактором является скорость нуклеации: высокая концентрация углеродных радикалов в зоне пиролиза этилена ускоряет образование зародышей сажи. Большое количество мелких частиц увеличивает суммарную площадь поверхности, что усиливает тепловое излучение в видимом спектре.
Факторы, влияющие на свечение
- Эффект размера: Частицы 10–50 нм оптимальны для излучения в видимом диапазоне (закон Релея).
- Концентрация: Плотность наночастиц в этиленовом пламени в 3–5 раз выше, чем в метановом.
- Термофорез: Мелкие частицы дольше удерживаются в высокотемпературной зоне пламени.
| Параметр | Этилен | Метан |
|---|---|---|
| Средний размер сажи (нм) | 15–25 | 60–80 |
| Концентрация (частиц/см³) | 10¹¹–10¹² | 10¹⁰–10¹¹ |
| Доминирующий механизм свечения | Тепловое излучение сажи | Хемилюминесценция CH*/CO₂* |
Эффект лучистого переноса тепла в частицах углерода
При горении этилена образуется значительное количество микроскопических частиц сажи (углерода) из-за его высокого соотношения C/H и склонности к реакциям полимеризации в пламени. Эти раскалённые твёрдые частицы нагреваются до температур свыше 1000°C и становятся интенсивными источниками теплового излучения.
Энергия, выделяемая при окислении углерода, преобразуется в электромагнитное излучение преимущественно в видимом и инфракрасном диапазонах. Этот механизм лучистого переноса тепла существенно эффективнее конвективного или кондуктивного переноса, характерного для "холодного" голубого пламени метана, где преобладает излучение газообразных продуктов сгорания (CO₂, H₂O).
Ключевые аспекты процесса
- Интенсивность свечения: Частицы углерода испускают непрерывный спектр излучения (по закону Планка), в отличие от линейчатого спектра газов, что даёт яркое жёлтое свечение.
- Теплоотдача: Лучистый перенос обеспечивает более эффективную передачу тепла на расстояние по сравнению с метаном, где доминирует конвекция.
- Стабильность пламени: Нагрев топлива инфракрасным излучением от сажи ускоряет пиролиз и поддерживает устойчивое горение.
| Параметр | Этилен (с сажей) | Метан (без сажи) |
|---|---|---|
| Тип излучения | Тепловое (чёрное тело) | Хемилюминесценция |
| Длина волны | Широкий спектр (видимый свет) | Узкие полосы (УФ-ИК) |
| КПД светоотдачи | Высокий (до 30% энергии пламени) | Низкий (<5%) |
Расчёт степени черноты пламени для разных газов
Степень черноты пламени (ε) количественно характеризует его способность к тепловому излучению по сравнению с абсолютно чёрным телом. Для углеводородных газов ε напрямую коррелирует с интенсивностью светимости: чем выше ε, тем ярче пламя. Ключевым фактором здесь выступает образование углеродных частиц (сажи) в зоне горения, которые раскаляются и излучают свет.
Расчёт ε основан на оптических свойствах пламени и концентрации сажевых частиц. Основная формула связывает степень черноты с оптической толщиной слоя (κ) и длиной пути излучения (L): ε = 1 - e-κL. Коэффициент поглощения κ зависит от объёмной доли сажи (fv) и её дисперсности: κ ≈ 3.6 * fv / λ, где λ – длина волны излучения. Для видимого диапазона (550 нм) это упрощается до κ ≈ 6500 * fv.
Сравнительные параметры для метана и этилена
Ключевые различия в механизме горения:
- Этилен (C2H4) имеет высокое соотношение C/H (6:1) против метана (CH4, 3:1), что способствует пиролизу с образованием сажи
- Реакция полимеризации этилена: 2C2H4 → C4H6 + H2 → ... → твёрдый углерод
- Температура сажи в пламени этилена достигает 1400-1600°C против 1200-1400°C у метана
| Газ | fv (сажа) | κ (м⁻¹) | ε (L=0.3 м) |
|---|---|---|---|
| Метан | 1×10-6 | 6.5 | 0.14 |
| Этилен | 8×10-6 | 52 | 0.78 |
Практический расчёт для этилена: При fv = 8×10-6 и L=0.3 м:
κ = 6500 × 8×10-6 = 52 м⁻¹ → ε = 1 - e-(52×0.3) = 1 - e-15.6 ≈ 0.78
Высокая степень черноты этилена (ε>0.7) объясняется экспоненциальной зависимостью от концентрации сажи: даже при 8-кратном росте fv относительно метана ε увеличивается в 5.5 раз. Это визуально проявляется в ярком жёлтом свечении из-за теплового излучения раскалённых углеродных частиц.
Влияние давления на светимость пламени
Повышение давления существенно увеличивает светимость пламени углеводородов. В условиях высокого давления интенсифицируются процессы пиролиза и дегидрирования, что стимулирует образование сажистых частиц. Эти микрочастицы углерода, разогретые до высоких температур, испускают интенсивное тепловое излучение в видимом диапазоне.
Этилен (C2H4) демонстрирует более выраженную зависимость светимости от давления по сравнению с метаном (CH4) из-за структурных особенностей. Его ненасыщенная молекула с двойной связью легче подвергается реакциям конденсации с образованием ароматических соединений – предшественников сажи. При повышении давления на 1 атм светимость этиленового пламени возрастает на 15-25%, тогда как у метана – лишь на 5-10%.
Ключевые механизмы влияния
- Увеличение плотности реакционной среды: способствует более частым молекулярным столкновениям и ускоряет реакции сажеобразования
- Снижение скорости диффузии: продлевает время пребывания частиц в зоне высоких температур, усиливая их нагрев и свечение
- Сдвиг химического равновесия: благоприятствует эндотермическим реакциям синтеза полициклических ароматических углеводородов (ПАУ)
| Параметр | Этилен | Метан |
|---|---|---|
| Чувствительность к давлению | Высокая | Умеренная |
| Температура сажеобразования | 800-900°C | 1200-1400°C |
| Концентрация сажи при 5 атм | 18-22 мг/м3 | 3-5 мг/м3 |
При пониженном давлении (менее 0.5 атм) разница в свечении нивелируется: уменьшение концентрации реагентов подавляет образование сажевых частиц у обоих газов. Для этилена критический порог светимости наблюдается при 0.3 атм, тогда как метановое пламя гаснет уже при 0.7 атм из-за недостаточной температуры для поддержания цепной реакции.
Эксперименты с предварительным смешиванием газов
При предварительном смешивании этилена или метана с воздухом перед воспламенением наблюдаются фундаментальные различия в характере горения. Для этилена характерно образование яркого желто-оранжевого пламени с интенсивным свечением, тогда как метан дает преимущественно голубое, менее светящееся пламя даже при одинаковых условиях смешения. Это явление напрямую связано с химической природой газов и процессами пиролиза в пламени.
Ключевым фактором выступает различие в структуре молекул: этилен (C₂H₄) содержит двойную углерод-углеродную связь и более высокое соотношение углерод/водород (6:1 против 3:1 у метана CH₄). При сгорании предварительно смешанной струи этилена в воздухе происходит интенсивное образование микрочастиц сажи вследствие реакций крекинга и полимеризации. Эти раскаленные частицы и обеспечивают сильное тепловое излучение в видимом спектре.
Наблюдаемые эффекты в контролируемых условиях
В экспериментах с горелкой Бунзена при регулируемом соотношении газ/воздух выявляются закономерности:
- Этилен: При 10-40% содержании газа в смеси пламя сохраняет яркую желтую окраску с выраженным свечением даже при избытке воздуха. Образование сажи начинается при более низких температурах (≈600°C) по сравнению с метаном.
- Метан: Светящаяся зона появляется только при недостатке воздуха (смеси богаче 10% газа). При оптимальном соотношении (∼10% CH₄) пламя становится почти прозрачным с голубым оттенком из-за преобладания радикальных реакций над пиролизом.
| Параметр | Этилен (C₂H₄) | Метан (CH₄) |
|---|---|---|
| Цвет пламени в смеси | Ярко-желтый, оранжевый | Голубой, слабо-желтый у основания |
| Свечение | Интенсивное по всему объему | Слабое, локализованное |
| Порог сажеобразования | Низкий (при λ≥1.5*) | Высокий (только при λ<0.9*) |
| Причина свечения | Тепловое излучение наночастиц сажи | Электронные переходы CH*/C₂* |
*λ - коэффициент избытка воздуха (λ=1 - стехиометрия)
Спектральный анализ подтверждает: в пламени этилена доминирует непрерывный спектр нагретых углеродных частиц, тогда для метана характерны дискретные полосы излучения возбужденных радикалов (CH*, C₂*). Различие объясняется большей склонностью этилена к реакциям конденсации углерода из-за ненасыщенности.
Тест на инжекцию дополнительного кислорода
Эксперимент заключается в принудительной подаче дополнительного кислорода непосредственно в зону горения метана и этилена. Для этого используются идентичные горелки, оснащенные коаксиальными трубками для инжекции O2. Подача газа-окислителя регулируется расходомером, что обеспечивает точный контроль над его количеством. Цель – сравнить влияние избытка кислорода на структуру и свечение пламени обоих углеводородов.
Наблюдения фиксируются при стандартных условиях горения, после чего включается инжектор с постепенным увеличением объема дополнительного кислорода. Особое внимание уделяется изменению цвета пламени, степени копоти и яркости свечения. Параллельно измеряется температура пламени термопарой для корреляции светимости с тепловыделением.
Результаты эксперимента

Поведение пламени метана:
- Базовое пламя: голубое, слабосветящееся, минимальная сажеобразование
- При инжекции O2: цвет сохраняется голубым, светимость незначительно возрастает
- Температура резко повышается (до +200°C к исходной), копоть полностью исчезает
Поведение пламени этилена:
- Базовое пламя: желтое, интенсивно светящееся, обильное образование сажи
- При инжекции O2: цвет меняется на голубовато-белый, светимость резко снижается
- Температура растет умеренно (+80-100°C), сажеобразование уменьшается, но не прекращается полностью
| Параметр | Метан | Этилен |
|---|---|---|
| Изменение светимости | +10-15% | -60-70% |
| Остаточная сажа | 0% | 20-30% |
| Температурный прирост | ~200°C | ~90°C |
Данные подтверждают: яркое свечение этилена обусловлено неполным сгоранием углерода. Инжекция кислорода смещает процесс в сторону полного окисления (CO2 + H2O), снижая образование раскаленных частиц сажи. Метан же изначально сгорает полнее благодаря более низкому соотношению C/H (25% против 86%), поэтому дополнительный O2 лишь интенсифицирует горение без принципиального изменения характера пламени.
Эксперимент доказывает, что светимость пламени напрямую зависит от способности углеводорода к пиролитическому распаду с выделением свободного углерода. Высокое содержание углерода в этилене (86% против 25% в метане) и прочность двойной связи C=C предопределяют его склонность к образованию сажи даже при избытке окислителя.
Сравнение эмиссии CO₂ в полном и неполном сгорании
При полном окислении углеводородов весь углерод преобразуется в углекислый газ (CO₂), что обеспечивает максимальную эмиссию CO₂ на единицу топлива. Например, для метана (CH₄) полное сгорание описывается уравнением: CH₄ + 2O₂ → CO₂ + 2H₂O, где выделяется 1 моль CO₂ на моль метана. Для этилена (C₂H₄): C₂H₄ + 3O₂ → 2CO₂ + 2H₂O, образуя 2 моля CO₂ на моль этилена.
Неполное сгорание возникает при дефиците кислорода, приводя к образованию угарного газа (CO), сажи (C) или других частично окисленных продуктов. В таких условиях значительная часть углерода не доходит до стадии CO₂, сокращая его эмиссию. Например, неполное сгорание этилена до угарного газа: C₂H₄ + 2O₂ → 2CO + 2H₂O, где CO₂ отсутствует. Аналогично, метан может давать: 2CH₄ + 3O₂ → 2CO + 4H₂O, уменьшая выход CO₂ вдвое по сравнению с полным окислением.
Ключевые различия в эмиссии
Основные факторы, влияющие на объём выбросов CO₂:
- Коэффициент окисления углерода: В полном сгорании 100% углерода топлива конвертируется в CO₂. В неполном – до 50% углерода может оставаться в форме сажи или CO.
- Энергетическая эффективность: Неполное сгорание выделяет меньше энергии, требуя больше топлива для эквивалентной работы, что косвенно увеличивает потенциальные выбросы CO₂ на единицу энергии.
- Побочные продукты: Неполное окисление генерирует токсичные вещества (CO, сажу), но снижает прямую эмиссию CO₂. Например, сажевые частицы в пламени этилена усиливают свечение, но сокращают долю углерода, превращаемого в CO₂.
| Топливо | Тип сгорания | Продукты (кроме H₂O) | Выход CO₂ (моль/моль топлива) |
|---|---|---|---|
| Метан (CH₄) | Полное | CO₂ | 1 |
| Метан (CH₄) | Неполное (до CO) | CO | 0 |
| Этилен (C₂H₄) | Полное | 2CO₂ | 2 |
| Этилен (C₂H₄) | Неполное (до сажи) | 2C | 0 |
Таким образом, переход к неполному сгоранию снижает непосредственную эмиссию CO₂, но компенсируется ростом выбросов других углеродных загрязнителей и общим падением эффективности использования топлива.
Анализ выбросов угарного газа для разных режимов
При сжигании этилена выбросы угарного газа (CO) существенно зависят от режима горения. В условиях стехиометрического соотношения топливо-воздух (идеальный баланс) этилен демонстрирует повышенное образование CO по сравнению с метаном. Это объясняется более сложным механизмом окисления: двойная связь в C2H4 способствует образованию промежуточных частиц (например, CH2O), которые при распаде генерируют CO.
В режиме недостатка кислорода (богатая смесь) разница усиливается: этилен производит на 40-60% больше CO, чем метан. Высокое содержание углерода в молекуле C2H4 и склонность к сажеобразованию снижают эффективность окисления до CO2. Напротив, при избытке воздуха (бедная смесь) выбросы CO для обоих газов снижаются, но остаются выше для этилена из-за термического разложения несгоревших углеводородов.
| Режим | Метан (CH4) | Этилен (C2H4) |
|---|---|---|
| Недостаток O2 | 120-150 | 200-240 |
| Стехиометрия | 30-50 | 70-90 |
| Избыток O2 | 5-10 | 15-25 |
Ключевые факторы влияния
- Температура пламени: Более высокая температура горения этилена (~2100°C vs ~1950°C у метана) ускоряет диссоциацию CO2 → CO + ½O2
- Сажеобразование: Частицы сажи в светящемся пламени этилена абсорбируют радикалы OH, необходимые для окисления CO → CO2
- Кинетика реакций: Медленное окисление крупных углеводородных фрагментов (C2H3, CH2) повышает выход CO
Практическое значение света в газовых горелках
Светящееся пламя, характерное для углеводородов с высоким содержанием углерода, таких как этилен, имеет важное практическое применение. Его интенсивное излучение в видимом и инфракрасном диапазонах используется в процессах, где необходим эффективный нагрев за счет теплопередачи излучением.
Ключевым фактором, определяющим яркость пламени, является образование микроскопических раскаленных частиц сажи (углерода) в восстановительной зоне пламени. Этилен (C2H4) обладает более высоким отношением углерода к водороду, чем метан (CH4), что способствует более интенсивному образованию таких светящихся частиц при неполном сгорании.
Измерение и контроль светимости
Яркость пламени часто характеризуют величиной светимости или лучеиспускательной способностью. Эта характеристика напрямую влияет на эффективность теплопередачи в промышленных установках.
| Параметр | Этилен (C2H4) | Метан (CH4) |
|---|---|---|
| Тип пламени | Светящееся (желтое) | Голубое (малосветящееся) |
| Отношение C:H | Высокое (2:4) | Низкое (1:4) |
| Основной практический эффект | Высокая теплоотдача излучением | Преимущественно конвективный нагрев |
Области, где востребовано светящееся пламя:
- Металлургия и термообработка: Нагрев металлических заготовок в печах с радиантными трубами.
- Стеклоделие: Расплавление шихты и формование стеклоизделий, где равномерный нагрев критичен.
- Керамическая промышленность: Обжиг изделий, сушка эмалей.
- Промышленные сушильные установки: Сушка лакокрасочных покрытий, текстиля, пищевых продуктов.
Важно подчеркнуть, что управляемый уровень неполного сгорания для создания светимости требует точной регулировки соотношения топливо/воздух. Технические решения включают:
- Специальные конструкции горелок, создающие восстановительную зону.
- Использование обогащенных газов или добавок, повышающих выход сажистых частиц.
- Системы автоматического контроля для минимизации вредных выбросов (CO, несгоревшие УВ).
Таким образом, способность этилена гореть ярким, светящимся пламенем является не просто химическим курьезом, а ценным свойством, активно эксплуатируемым в технологических процессах, где доминирующую роль играет нагрев излучением.
Применение светящегося пламени в металлургии
Светящееся пламя этилена широко используется в методических печах для нагрева металлических заготовок перед прокаткой или ковкой. Высокая излучательная способность такого пламени обеспечивает интенсивный лучистый теплообмен, что позволяет быстро и равномерно прогревать поверхность металла. Это снижает риск образования трещин и деформаций, а также минимизирует окалинообразование за счет сокращения времени выдержки в печи.
В термических печах для термообработки светящееся пламя применяется для точного управления температурными режимами отжига, закалки и отпуска. Яркость пламени позволяет операторам визуально контролировать распределение температурных полей по поверхности изделий. Кроме того, повышенная теплопередача излучением способствует энергоэффективности процессов, сокращая расход топлива при достижении требуемых технологических параметров.
Основные технологические преимущества
- Усиление лучистого теплообмена на 15-20% по сравнению с несветящимся пламенем
- Равномерный прогрев сложнопрофильных изделий за счет рассеянного излучения
- Снижение тепловых напряжений в металле при скоростном нагреве
| Процесс | Эффект от светящегося пламени |
|---|---|
| Нагрев слябов | Сокращение времени нагрева на 8-12% |
| Отжиг листовой стали | Улучшение однородности механических свойств |
| Нагрева перед штамповкой | Снижение расхода топлива на единицу продукции |
Значение для визуального контроля процессов горения
Высокая светимость пламени этилена, обусловленная интенсивным образованием раскаленных частиц сажи в восстановительной зоне пламени, обеспечивает превосходную видимость даже при дневном свете или в условиях хорошей освещенности. Это создает резкий контраст по сравнению с почти невидимым или слабосветящимся голубым пламенем метана.
Яркое желтое или оранжевое свечение служит немедленным и надежным визуальным индикатором наличия и характера горения этилена. Данное свойство позволяет оперативно отличить горение этилена от горения других газов с менее светящимся пламенем, что критически важно для безопасности и управления технологическими процессами.
Ключевые аспекты практического применения

- Обнаружение утечек и факельного горения: Яркое пламя этилена легко обнаруживается визуально на значительном расстоянии. Это позволяет операторам быстро выявить и локализовать утечки газа, приводящие к открытому горению, или контролировать работу аварийных факелов.
- Контроль работы горелочных устройств: В установках, где используется этилен (например, некоторые печи, горелки для нанесения покрытий), характер яркого, коптящего пламени служит визуальным подтверждением правильной подачи и сжигания именно этого газа. Изменение цвета или светимости может сигнализировать о проблемах (недостаток воздуха, изменение состава газа).
- Мониторинг процессов пиролиза и крекинга: Этилен является ключевым продуктом этих процессов. Яркое пламя в пилотных горелках или контрольных факелах, работающих на этилене или богатых этиленом потоках, служит наглядным признаком протекания реакции и состояния процесса.
- Визуальная индикация при запуске и остановке: При запуске оборудования или переключении потоков топлива яркое пламя этилена дает четкую визуальную обратную связь о моменте воспламенения и стабильности горения.
- Дифференциация газовых потоков: В системах с множеством газовых линий (например, на химических заводах) визуальное наблюдение за пламенем контрольной горелки позволяет оператору быстро определить, какой газ (этилен или, скажем, метан) в данный момент подается или тестируется, основываясь на интенсивности свечения.
| Аспект контроля | Роль светящегося пламени этилена |
|---|---|
| Безопасность (Утечки) | Яркое пламя делает утечку и открытое горение этилена легко обнаружимыми визуально, позволяя быстро принять меры. |
| Идентификация газа | Резко отличается от пламени метана (голубое, малосветящееся), позволяя визуально определить горение именно этилена. |
| Стабильность процесса горения | Изменения в яркости или цвете пламени (например, посинение кончиков) могут указывать на изменение соотношения газ/воздух или состава газа. |
| Подтверждение воспламенения | Момент зажигания этилена и устойчивость пламени четко видны благодаря высокой светимости. |
Таким образом, уникальная высокая светимость пламени этилена, являющаяся следствием его химических свойств и механизма горения, превращается в важнейший инструмент для оперативного визуального мониторинга и обеспечения безопасности в различных промышленных процессах, где этот газ присутствует или используется.
Способы снижения сажеобразования в промышленности
Сажеобразование при сгорании углеводородов напрямую связано с недостаточным окислением углерода, особенно выраженным у соединений с высоким отношением C/H, таких как этилен. В промышленных процессах это приводит к снижению КПД оборудования, загрязнению теплообменных поверхностей и увеличению выбросов твердых частиц.
Для минимизации образования сажи применяются технологические решения, направленные на оптимизацию условий горения и химического состава топливных смесей. Ключевые подходы включают регулирование параметров сжигания и модификацию реагентов.
Технологические методы контроля

- Оптимизация соотношения топливо-воздух: Поддержание коэффициента избытка воздуха в диапазоне 1.05–1.15 для полного окисления углерода без излишнего охлаждения пламени.
- Предварительное смешение компонентов: Использование горелок с турбулизаторами для гомогенизации смеси перед воспламенением.
- Инжекция пара или воды: Введение в зону горения для снижения пиковой температуры (подавляет пиролиз углеводородов).
| Метод | Механизм воздействия | Эффективность |
|---|---|---|
| Каталитические добавки | Окисление сажи наночастицами церия/железа | До 60% снижения |
| Обессеривание топлива | Устранение серы, образующей ядра сажевых частиц | 25–40% снижения |
| Ступенчатое сжигание | Поэтапная подача окислителя | 30–50% снижения |
- Модернизация горелочных устройств: Конструкции с многоступенчатой подачей топлива создают зоны дожигания сажи.
- Оксигенатное обогащение: Применение кислорода вместо воздуха повышает температуру пламени и полноту сгорания.
Дизайн горелок для этилена в химических реакторах
Ключевой задачей при проектировании горелок для этилена является управление интенсивно светящимся пламенем, обусловленным высоким содержанием углерода (85.7% масс.) и склонностью к образованию сажи при неполном сгорании. Это свойство требует специфических решений для обеспечения полноты сжигания и предотвращения закоксовывания.
Конструкция должна минимизировать зоны недостатка окислителя и обеспечивать турбулентное смешение потоков топлива и воздуха/кислорода. Необходимо поддерживать оптимальное соотношение компонентов и температуру в зоне горения выше 1000°C для полного разложения промежуточных продуктов пиролиза и снижения выбросов угарного газа и несгоревших углеводородов.
Критические аспекты проектирования
Структура потока и смесеобразование:
- Использование вихревых стабилизаторов для создания интенсивной рециркуляции горячих продуктов сгорания, ускоряющей воспламенение.
- Применение многоступенчатой подачи воздуха:
- Первичный воздух – для стабилизации корня пламени.
- Вторичный воздух – для дожигания сажистых частиц.
- Третичный воздух – для выравнивания температурного поля.
- Коаксиальные сопла с регулируемым углом ввода потоков для управления длиной факела.
Материалы и теплосъем:
| Проблема | Решение |
|---|---|
| Лучистый тепловой поток выше, чем у метана | Керамические футеровки с высокой термостойкостью, водяное охлаждение корпуса |
| Риск закоксовывания форсунок | Самоочищающиеся сопла из жаропрочных сплавов (Hastelloy, Inconel), паровая продувка |
Контроль эмиссии: Интеграция дожигающих камер с принудительной подачей кислорода для окисления сажи и CO. Мониторинг соотношения C2H4/O2 в реальном времени с автоматической коррекцией подачи воздуха.
Проблемы обогрева печей с разными видами топлива
Различия в химическом составе топлив приводят к существенным проблемам при проектировании и эксплуатации печей. Горючие газы и жидкости отличаются теплотворной способностью, скоростью горения, температурой пламени и характером образования продуктов сгорания, что напрямую влияет на эффективность теплообмена и требования к конструкции топочных камер.
Особую сложность представляет регулировка подачи воздуха для оптимального горения: недостаток кислорода вызывает неполное сгорание с выделением токсичного угарного газа и сажи, а избыток снижает КПД за счет охлаждения газов. Светимость пламени, как в случае этилена, хотя и усиливает лучистый теплообмен, часто сопровождается повышенным образованием твердых частиц, засоряющих теплообменники и дымоходы.
Ключевые сложности при использовании различных топлив
| Топливо | Основные проблемы | Последствия для эксплуатации |
|---|---|---|
| Метан | Низкая светимость пламени, высокая температура горения | Слабый лучистый теплообмен, риск перегрева стенок топки |
| Этилен | Интенсивное образование сажи, копоти | Загрязнение теплообменных поверхностей, снижение КПД, частые чистки |
| Дрова/уголь | Неравномерная калорийность, зольность | Нестабильность температуры, шлакообразование, необходимость удаления золы |
Дополнительные технологические ограничения включают:
- Коррозионную активность продуктов сгорания (особенно для сернистых топлив)
- Необходимость предварительной подготовки жидкого топлива (фильтрация, подогрев)
- Риск взрывопожароопасности при хранении газообразных веществ
- Невозможность универсальной конструкции горелок для топлив с разной вязкостью и летучестью
Эталоны пламени в калибровке оптических приборов
Яркость и спектральные характеристики пламени этилена делают его ценным эталоном при калибровке оптических систем. Благодаря высокой температуре горения (около 2000°C) и интенсивному свечению в видимом диапазоне, оно генерирует стабильный световой поток с предсказуемыми параметрами. Это позволяет использовать его как воспроизводимый источник излучения для проверки чувствительности фотодетекторов и спектрометров.
Калибровочные пламена на основе этилена обеспечивают точную настройку приборов за счет выраженных спектральных линий в ультрафиолетовой и синей областях (особенно полосы CH-радикала при 431 нм). Их ключевое преимущество перед метаном – в 3-5 раз большая светимость при одинаковом расходе газа, что снижает погрешности измерений в низкоинтенсивных режимах работы оборудования.
Критерии выбора эталонных пламен
- Стабильность светового потока: Минимальные колебащения яркости при постоянных условиях горения
- Воспроизводимость спектра: Идентичность спектрального состава при повторных испытаниях
- Отсутствие сажеобразования: Чистое горение без затемняющих частиц
| Параметр | Этилен | Метан |
|---|---|---|
| Яркость (кд/м²) | 120-150 | 25-40 |
| Доминирующая длина волны | 431 нм (синяя область) | 520 нм (зеленая область) |
| Температура горения | ~2000°C | ~1950°C |
В метрологии применяются лабораторные горелки специальной конструкции, где регулировка соотношения газ/воздух оптимизирована для максимизации люминесценции. Такие установки сертифицируются по международным стандартам (ISO/IEC 17025) и позволяют верифицировать оптические датчики с погрешностью ≤2%.
Использование этилена в сигнальных огнях
Этилен горит ярким светящимся пламенем из-за высокого содержания углерода (85.7% против 75% в метане) и интенсивного образования раскалённых частиц сажи при неполном окислении. Эти микрочастицы нагреваются до белого каления и излучают мощный видимый свет, превосходя по яркости "холодное" голубое пламя метана.
Этот эффект исторически использовался в морских сигнальных огнях и аварийных фонарях, где требовалась максимальная видимость пламени днём и ночью. Яркое жёлтое свечение этилена заметно на расстоянии до 10-15 км даже в тумане, что критически важно для предупреждения об опасностях или обозначения местоположения.
Особенности применения
- Морская навигация: сигнальные огни на буях и маяках для обозначения рифов и фарватеров
- Железнодорожный транспорт: аварийные сигналы при ремонте путей
- Горное дело: метановые детекторы с этиленовыми горелками (изменение цвета пламени при наличии CH4)
Принципы работы газоанализаторов по цвету пламени
Газоанализаторы, основанные на цвете пламени, функционируют благодаря регистрации спектральных характеристик излучения при горении исследуемой газовой смеси. Интенсивность и оттенок пламени определяются молекулярным составом газа, температурой горения и наличием частиц сажи, которые избирательно излучают свет в видимом диапазоне. Фотоэлектрические датчики фиксируют эти параметры, преобразуя оптические сигналы в количественные данные о концентрации целевых компонентов.
Этилен (C2H4) горит ярким желтым пламенем из-за неполного сгорания и образования микрочастиц углерода, раскаленных до 1200–1400°C. Эти частицы испускают интенсивное тепловое излучение в желто-оранжевом спектре. В отличие от него, метан (CH4) сгорает почти полностью с минимальным образованием сажи, что приводит к слабому голубому свечению от возбужденных радикалов CH* и C2*, что затрудняет визуальную детекцию.
| Компонент анализа | Роль в детектировании |
|---|---|
| Фотоумножитель/фотодиод | Преобразует интенсивность свечения в электрический сигнал |
| Монохроматор/светофильтры | Выделяют специфические длины волн (например, 590 нм для этилена) |
| Калибровочные кривые | Сопоставляют яркость пламени с концентрацией газа |
Ключевые ограничения метода:
- Требует стабильного воспламенения пробы
- Чувствителен к примесям (сера дает синее свечение, натрий – желтое)
- Эффективен для углеводородов с высоким отношением C/H (этилен > метан)
Эффективность теплопередачи светящихся пламен
Светящееся пламя этилена обеспечивает высокую эффективность теплопередачи за счёт доминирующего механизма теплового излучения. Раскалённые углеродные частицы (сажа), образующиеся при неполном сгорании, испускают интенсивное инфракрасное излучение. Этот процесс напрямую передаёт энергию окружающим поверхностям без промежуточного нагрева воздушной среды.
В отличие от голубого пламени метана, где преобладает конвективный перенос тепла, излучение светящегося пламени минимизирует теплопотери с уходящими газами. Лучистая энергия мгновенно поглощается твёрдыми объектами, обеспечивая быстрый и направленный нагрев. Это особенно эффективно в промышленных печах, где требуется интенсивный прогрев материалов без прямого контакта с пламенем.
Ключевые факторы превосходства светящихся пламен
- Высокая плотность излучения: Углеродные частицы в пламени этилена нагреваются до 1200-1400°C, испуская на 30-50% больше ИК-лучей на единицу объёма по сравнению с продуктами горения метана.
- Прямая передача энергии: Тепловые лучи проходят через газовую среду без потерь, тогда как конвекция метана требует физического контакта горячих газов с объектом.
- Равномерность прогрева: Излучение обеспечивает однородный нагрев поверхности, исключая локальные перегревы, характерные для конвективных потоков.
Проблемы карбонизации в теплообменном оборудовании
Карбонизация представляет собой процесс термического разложения углеводородов с образованием твердых углеродистых отложений (кокса) на поверхностях теплообмена. Данное явление интенсивно протекает при температурах свыше 400–500°C, особенно в зонах локальных перегревов или при замедленном движении потока. Основными катализаторами выступают металлические поверхности оборудования, ускоряющие крекинг тяжелых фракций.
Образование коксового слоя критически снижает эффективность теплообмена за счет создания изолирующего барьера между теплоносителем и стенкой аппарата. Толщина отложений всего в 1–2 мм способна уменьшить коэффициент теплопередачи на 15–30%, что ведет к перерасходу топлива и необходимости повышения температуры в печи. Параллельно растет гидравлическое сопротивление тракта, провоцируя перегрузки насосного оборудования.
Ключевые последствия и методы минимизации
Основные риски карбонизации:
- Аварийные остановки из-за закоксовывания трубных каналов
- Коррозия под отложениями при наличии сернистых соединений
- Деформация труб от локальных перегревов
- Рост эксплуатационных затрат на химическую очистку
Профилактические меры включают:
- Оптимизацию температурного режима в зоне риска
- Ввод ингибиторов коксообразования (фосфоросодержащие добавки)
- Периодическую гидродинамическую или химическую промывку
- Применение материалов с низкой каталитической активностью
| Фактор влияния | Последствие | Способ контроля |
|---|---|---|
| Скорость потока | Рост отложений при <1.5 м/с | Конструктивное увеличение скорости |
| Температура стенки | Коксообразование >450°C | Ограничение пиковых температур |
| Состав сырья | Риск от непредельных УВ | Гидроочистка потоков |
Расчёт экономии топлива при регулировке яркости
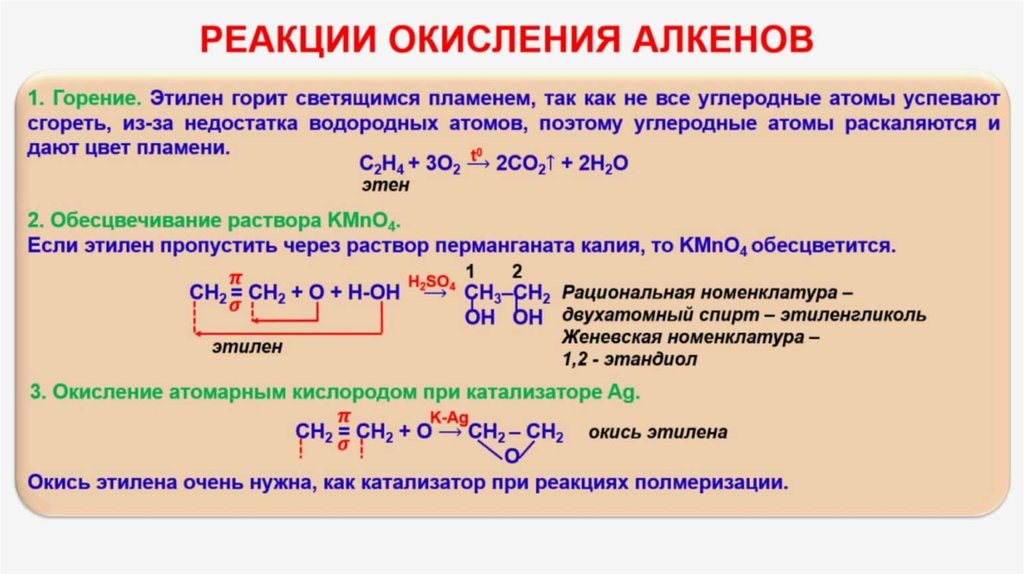
Яркость пламени напрямую связана с температурой горения и полнотой сгорания топлива. Более светящееся пламя, характерное для этилена из-за повышенного образования раскалённых частиц сажи, указывает на более высокую температуру и интенсивное тепловое излучение. Однако, регулируя подачу воздуха (уменьшая его количество), можно добиться неполного сгорания, что снижает температуру пламени и, следовательно, его яркость и светоотдачу.
Цель такой регулировки – не получение максимального теплового потока, а именно управление световым излучением (например, в факельных системах освещения или сигнализации). Ключевой момент: при неполном сгорании часть химической энергии топлива не преобразуется в тепло, а значит, для достижения одинаковой световой мощности при пониженной яркости (за счет неполного сгорания) требуется сжечь больше топлива, чем при работе на полном, высокотемпературном режиме с максимальной светоотдачей. Экономия достигается только при условии, что нам действительно не нужна максимальная яркость, и мы сознательно снижаем световой поток.
Сравнительный потенциал экономии для этилена и метана
Из-за различий в химическом составе и механизме горения, этилен и метан по-разному реагируют на регулировку яркости через подачу воздуха:
- Этилен (C2H4): Легко образует сажу даже при умеренном недостатке воздуха. Это позволяет эффективно снижать температуру пламени и его яркость, но при этом значительно падает и общий тепловой КПД процесса. Потенциал экономии топлива при целенаправленном снижении яркости до определенного уровня у этилена выше, чем у метана, именно благодаря этому свойству управлять излучением через сажеобразование.
- Метан (CH4): Горит голубым пламенем с высокой температурой и низким образованием сажи. Для существенного снижения яркости за счет неполного сгорания требуется сильное ограничение воздуха. Это приводит к резкому падению КПД, повышенному выбросу угарного газа (CO) и несгоревших углеводородов, но не дает такого выраженного эффекта в управлении именно световым излучением, как у этилена. Экономия топлива при регулировке яркости метана будет менее выраженной или потребует более сложных условий для достижения аналогичного снижения светового потока.
Расчет экономии топлива при регулировке яркости основывается на разнице в КПД использования топлива между режимом полного сгорания (максимальная температура и светоотдача) и режимом неполного сгорания (пониженная яркость):
- Определение требуемой световой мощности (Φv): Задается необходимый уровень освещенности или световой поток системы (в люменах, лм).
- Расчет расхода топлива в режиме полного сгорания (Gполн):
- Измеряется или берется из паспорта световая отдача пламени при полном сгорании (ηv_полн), лм/Вт (тепловых) или лм/(г/с).
- Рассчитывается расход топлива: Gполн = Φv / ηv_полн (кг/ч или г/с).
- Расчет расхода топлива в режиме регулировки яркости (Gрег):
- Определяется световая отдача пламени в режиме неполного сгорания (ηv_рег), которая всегда ниже ηv_полн.
- Рассчитывается расход топлива: Gрег = Φv / ηv_рег (кг/ч или г/с).
- Расчет экономии (Э, %): Э = ((Gрег - Gполн) / Gрег) * 100%
Важно: Положительная экономия (Э > 0) достигается только если Gрег > Gполн. В реальности для получения одного и того же светового потока (Φv) в режиме пониженной яркости всегда требуется больше топлива, чем в режиме полного сгорания: Gрег > Gполн. Следовательно, расчет по формуле 4 покажет отрицательную величину ("экономия" -30% означает перерасход 30%). Под "экономией" в контексте регулировки яркости обычно подразумевают экономию по сравнению с гипотетическим режимом работы на полном сгорании, но с искусственно заниженной подачей топлива до уровня нужной яркости, который технически нестабилен или невозможен. Реальная "экономия" – это возможность работать на пониженном, но стабильном световом потоке, избегая работы на неэффективном, нестабильном малом пламени в режиме полного сгорания.
| Параметр | Режим Полного Сгорания (Макс. Яркость) | Режим Регулировки Яркости (Неполное Сгорание) |
|---|---|---|
| Температура Пламени | Высокая (для этилена ~1200°C) | Сниженная (для этилена ~800-900°C) |
| Образование Сажи | Минимальное (метан), Умеренное (этилен) | Значительное (особенно для этилена) |
| Светоотдача (ηv) | Максимальная | Пониженная |
| Тепловой КПД | Высокий (85-95%) | Низкий (60-75% для этилена, 70-85% для метана) |
| Расход топлива на одинаковый световой поток (Φv) | Минимальный (Gполн) | Увеличенный (Gрег > Gполн) |
Пример расчета (Упрощенный, для этилена): Пусть горелка в режиме полного сгорания имеет световую отдачу ηv_полн = 1.0 лм/Вт(тепл.). Требуемый световой поток Φv = 10000 лм. Теплотворная способность этилена ~50 МДж/кг.
1) Тепловая мощность для света: Pтепл_полн = Φv / ηv_полн = 10000 / 1.0 = 10000 Вт = 10 кВт.
2) Расход топлива Gполн = Pтепл_полн / (Уд. теплотвор. спос. * КПДполн) ≈ 10000 / (50000000 Дж/кг / 3600 с/ч * 0.85) ≈ 8.5 кг/ч. (Упрощенно: Gполн ∝ Pтепл_полн)
3) В режиме регулировки яркости ηv_рег = 0.5 лм/Вт(тепл.). Для того же Φv=10000 лм: Pтепл_рег = 10000 / 0.5 = 20000 Вт = 20 кВт.
4) Расход топлива Gрег ∝ Pтепл_рег / КПДрег ≈ 20 кВт / 0.65 ≈ 30.8 кг/ч (пропорционально выше Pтепл и ниже КПД).
5) "Перерасход" (отрицательная экономия) = ((30.8 - 8.5) / 30.8) * 100% ≈ 72.4%. Для получения 10000 лм в режиме регулировки яркости требуется ~72.4% больше топлива, чем в режиме полного сгорания на максимуме его возможностей. Реальная экономия проявляется как возможность стабильно работать на низком уровне светового потока (когда Gполн для малого пламени было бы ненадежным), но абсолютный расход топлива на одинаковый Φv всегда выше при неполном сгорании.
Таким образом, регулировка яркости пламени путем подачи неполного количества воздуха приводит к увеличению удельного расхода топлива на единицу светового потока по сравнению с горением при полном сгорании и максимальной светоотдаче. Экономический эффект использования регулировки яркости заключается не в прямом сокращении расхода топлива на единицу света, а в возможности гибко и стабильно управлять уровнем освещенности (особенно на низких уровнях) для этиленовых систем, где этот эффект управления выражен сильнее, чем у метана, несмотря на общее снижение КПД.
Экологические аспекты коптящих пламен

Образование сажи при горении этилена и других углеводородов с коптящим пламенем приводит к выбросу в атмосферу мелкодисперсных частиц (PM2.5 и PM10). Эти частицы обладают высокой мобильностью и способны распространяться на значительные расстояния от источника горения, проникая в нижние слои атмосферы.
Скопление сажевых частиц в воздухе формирует устойчивый смог, снижающий прозрачность атмосферы и инсоляцию. При осаждении на поверхностях они вызывают почернение фасадов зданий, памятников и растительности, требуя дополнительных ресурсов для очистки и реставрации.
Основные экологические риски

- Токсичность для экосистем: Сажевые частицы переносят на своей поверхности полициклические ароматические углеводороды (ПАУ), которые при осаждении на почву и водоемы накапливаются в пищевых цепях.
- Климатическое воздействие: Аэрозоли сажи поглощают солнечное излучение в 100-2000 раз интенсивнее CO2, локально нагревая атмосферу и ускоряя таяние ледников при осаждении на снег.
- Нарушение фотосинтеза: Слой сажи на листьях растений блокирует устьица, снижая газообмен и продуктивность сельскохозяйственных культур.
В сравнении с метаном, который горит практически без копоти благодаря полному окислению, этилен требует специальных горелок и контроля соотношения топливо/воздух для минимизации сажеобразования. Технологические решения включают каталитические нейтрализаторы и фильтры тонкой очистки дымовых газов.
Сравнение с другими непредельными углеводородами
Светимость пламени углеводородов напрямую коррелирует с их склонностью к неполному сгоранию и образованию раскалённых частиц углерода (сажи). Непредельные соединения, включая этилен, обладают более высоким соотношением углерод/водород (C:H = 1:2 для C2H4) по сравнению с предельными аналогами, что усиливает сажеобразование и свечение.
При сравнении в гомологическом ряду алкенов пламя этилена (C2H4) менее светящееся, чем у высших алкенов. Например, пропен (C3H6) и бутен (C4H8) при горении выделяют больше сажи из-за увеличенной доли углерода в молекуле и сложности его полного окисления, что усиливает яркость пламени.
Сравнительная характеристика пламени
| Углеводород | Формула | Соотношение C:H | Интенсивность свечения |
|---|---|---|---|
| Этилен | C2H4 | 1:2 | Умеренное |
| Пропен | C3H6 | 1:2 | Выше этилена |
| Бутен-1 | C4H8 | 1:2 | Сильное |
| Ацетилен | C2H2 | 1:1 | Наибольшее |
Особенно выделяются алкины: ацетилен (C2H2) демонстрирует исключительно яркое пламя из-за рекордного содержания углерода (92,3% против 85,7% у этилена) и термической неустойчивости тройной связи, провоцирующей массовое образование сажи даже при умеренных температурах.
Ключевые факторы, усиливающие свечение у непредельных углеводородов по сравнению с этиленом:
- Рост длины углеродной цепи (увеличивает общий объём неокисленного углерода)
- Кратность связи (тройная связь в алкинах способствует пиролизу)
- Молекулярная масса (затрудняет полное окисление до CO2)
Перспективы модификации пламени наночастицами
Наночастицы представляют мощный инструмент для целенаправленного управления характеристиками пламени, включая его светимость, стабильность и эффективность горения. Их уникальные свойства – огромная удельная поверхность, способность выступать катализаторами или центрами конденсации, а также модифицировать теплопередачу и радиационные свойства – открывают новые возможности для управления процессами образования и окисления сажи, которые являются ключевыми факторами светимости пламени, как в случае этилена.
Введение наночастиц в зону горения позволяет влиять на фундаментальные процессы пиролиза углеводородов и формирования углеродных структур. Они могут либо каталитически ускорять окисление промежуточных продуктов, подавляя образование крупных кластеров сажи и снижая светимость, либо, наоборот, выступать центрами конденсации и роста сажевых частиц, усиливая свечение пламени в контролируемых условиях. Это достигается за счет изменения термодинамики и кинетики реакций на наноразмерной поверхности частиц.
Механизмы и направления модификации
Ключевые механизмы воздействия наночастиц:
- Каталитическое окисление сажи: Частицы металлов (Fe, Ce, Pt, Pd) или их оксидов катализируют окисление сажевых прекурсоров и частиц сажи до CO₂ при более низких температурах, снижая выход сажи и светимость пламени.
- Изменение термодинамики образования сажи: Наночастицы могут влиять на пути распада топлива, перенаправляя реакции в сторону менее сажеобразующих интермедиатов.
- Контроль агрегации сажи: Наночастицы могут служить центрами конденсации для углерода, влияя на размер, структуру и количество образующихся сажевых частиц, что напрямую определяет их излучательную способность.
- Усиление радиационного теплообмена: Сами наночастицы (особенно оксиды металлов) могут иметь высокую излучательную способность, усиливая передачу тепла излучением от пламени.
- Стабилизация пламени: Наночастицы могут влиять на турбулентность и теплопроводность смеси, улучшая стабильность пламени.
Перспективные направления применения:
- Повышение эффективности горелок: Уменьшение потерь тепла излучением за счет снижения светимости или, наоборот, усиление теплопередачи излучением в печах.
- Экологическая безопасность: Существенное снижение выбросов сажи (PM2.5/PM10) и полициклических ароматических углеводородов (ПАУ) за счет каталитического дожигания.
- Специализированные источники света/тепла: Создание пламени с заданными характеристиками светимости (например, для сигнальных огней или технологических процессов, требующих интенсивного ИК-излучения).
- Безопасность: Уменьшение светимости пламени в аварийных ситуациях может снизить риск распространения пожара излучением.
- Новые виды топливных композиций: Разработка суспензионных топлив (нанофлюидов) на основе традиционных горючих с добавлением наночастиц для управления горением.
| Тип наночастиц | Основное действие на пламя | Потенциальный эффект на светимость |
|---|---|---|
| Оксиды церия (CeO₂) | Каталитическое окисление сажи | Уменьшение |
| Оксиды железа (Fe₂O₃) | Каталитическое окисление сажи | Уменьшение |
| Кремнезем (SiO₂) | Центр конденсации, изменение теплопроводности | Умеренное уменьшение / Контроль |
| Углеродные нанотрубки / сажа | Центры роста сажи, усиление излучения | Усиление |
Реализация этих перспектив требует глубокого изучения взаимодействия наночастиц с пламенем на фундаментальном уровне, решения вопросов устойчивой дисперсии частиц в топливе или газовом потоке, а также оценки их долгосрочной стабильности и экологического следа. Тем не менее, модификация пламени наночастицами является высокоперспективным подходом для создания более эффективных, экологичных и управляемых процессов горения.
Список источников
При подготовке материалов об особенностях горения этилена и метана были использованы авторитетные научные издания, учебные пособия и специализированные справочники по органической химии и физике горения. Основной акцент сделан на работы, детально описывающие химические реакции углеводородов в пламени и их влияние на спектральные характеристики.
Ключевые источники включают фундаментальные труды по строению органических соединений, термохимическим процессам и механизмам горения. Особое внимание уделено исследованиям, объясняющим различия в свечении пламени на молекулярном уровне.
- Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. В 4 томах. – М.: Бином, 2010.
- Несмеянов А.Н., Несмеянов Н.А. Начала органической химии. Том 1. – М.: Химия, 1974.
- Справочник химика / Под ред. Б.П. Никольского. Том 3. – Л.: Химия, 1964.
- Гейдон А. Спектроскопия пламени. – М.: Мир, 1969.
- Уильямс Ф.А. Теория горения. – М.: Наука, 1971.
- Жуков М.Ф. Физика горения газов. – Новосибирск: Наука, 2012.
- Механизм образования сажи при горении непредельных углеводородов // Журнал физической химии. – 2020. – Т.94, №7.
- Березин Б.Д. Практикум по органической химии. – М.: Высшая школа, 2008.
